16.4: Propiedades espectroscópicas
- Page ID
- 73573
Espectros Infrarrojos
Un grupo carbonilo en un compuesto puede identificarse positivamente por la fuerte banda de absorción infrarroja en la región\(1650\)\(1850 \: \text{cm}^{-1}\), lo que corresponde a la vibración de estiramiento del doble enlace carbono-oxígeno. La posición de la banda dentro de este rango de frecuencia depende del entorno molecular del grupo carbonilo. Como resultado, frecuentemente podemos decir desde la posición de la banda si la estructura es un aldehído, cetona, ácido carboxílico, éster, amida o anhídrido. La fecha del Cuadro 16-3 muestra frecuencias típicas de absorción infrarroja para tipos específicos de compuestos carbonílicos. Así, los aldehídos y cetonas absorben a frecuencias ligeramente más bajas (longitudes de onda más largas) que los ésteres y anhidridos carboxílicos. Generalmente encontramos que la absorción se desplaza a frecuencias más bajas\(\left( \sim 20 \: \text{cm}^{-1} \right)\) cuando el grupo carbonilo se conjuga con otros enlaces múltiples, como en las cetonas aromáticas,\(\ce{C_6H_5COCH_3}\).
Tabla 16-3: Frecuencias de absorción infrarroja características de compuestos carbonílicos\(^a\)

Los aldehídos se pueden distinguir de las cetonas por una banda en la\(2720 \: \text{cm}^{-1}\) que es característica de la vibración de\(\ce{C-H}\) estiramiento de una función aldehído:

Esta banda es inusualmente baja en frecuencia para una vibración de\(\ce{C-H}\) estiramiento; aunque la banda es bastante débil, ocurre en una región del espectro donde otras absorciones generalmente están ausentes por lo que se puede identificar sin ninguna dificultad especial.
Espectros de absorción electrónica
Los aldehídos y cetonas absorben la luz ultravioleta en la región\(275\) -\(295 \: \text{nm}\), y el resultado es la excitación de un electrón no compartido sobre el oxígeno a un nivel de energía más alto. Esta es la\(n \rightarrow \pi^*\) transición que se discute en la Sección 9-9. Una\(\pi \rightarrow \pi^*\) transición más intensa ocurre alrededor de\ 180\) -\(190 \: \text{nm}\), que corresponde a la excitación de un electrón de un orbital de\(\pi\) unión a un orbital\(\pi\) -antienlace. Ninguna de estas absorciones es especialmente útil para la identificación específica a menos que el grupo carbonilo esté conjugado, en cuyo caso las\(\pi \rightarrow \pi%+^*\) bandas\(n \rightarrow \pi^*\) y ocurren a longitudes de onda más largas (por\(30\) -\(40 \: \text{nm}\)). Por ejemplo, si sospechas que un compuesto es una alquenona de su espectro infrarrojo, fácilmente podrías decir por\(\pi \rightarrow \pi^*\) las absorciones\(n \rightarrow \pi^*\) y del compuesto si se trata de una alquenona conjugada.\(\lambda_\text{max}\) La frecuencia de absorción se esperaría alrededor\(320 \: \text{nm}\) y\(220 \: \text{nm}\) (ver Figura 9-20).
Espectros de Masa
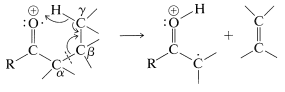
Los aldehídos y cetonas generalmente dan señales moderadamente intensas debido a sus iones moleculares,\(\ce{M^+}\). Por lo tanto, la determinación del peso molecular de una cetona por espectroscopia de masas no suele ser difícil. Además, existen algunos patrones característicos de fragmentación que ayudan a la identificación estructural. Estos son:
- \(\alpha\)escote
.png)
- transferencia de\(\gamma\) hidrógeno con\(\beta\) escisión (reordenamiento de McLafferty)
Espectros de RMN
El carácter del enlace carbonilo da lugar a absorciones de RMN de campo muy bajo para el protón de un grupo aldehído\(\left( \ce{-CH=O} \right)\). Como muestra el Cuadro 9-4, estas absorciones son algunas\(4 \: \text{ppm}\) a campos menores que los hidrógenos alquenil (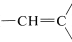 ). Parte de esta diferencia en el desplazamiento puede atribuirse a la polaridad del grupo carbonilo\(\overset{\delta \oplus}{\ce{C}} \ce{=} \overset{\delta \ominus}{\ce{O}}\), lo que reduce la densidad de electrones alrededor del hidrógeno aldehído (ver Sección 9-10E). El efecto parece trasladarse en grado mucho menor en las\(\alpha\) posiciones, y los protones del tipo
). Parte de esta diferencia en el desplazamiento puede atribuirse a la polaridad del grupo carbonilo\(\overset{\delta \oplus}{\ce{C}} \ce{=} \overset{\delta \ominus}{\ce{O}}\), lo que reduce la densidad de electrones alrededor del hidrógeno aldehído (ver Sección 9-10E). El efecto parece trasladarse en grado mucho menor en las\(\alpha\) posiciones, y los protones del tipo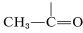 están\(0.3 \: \text{ppm}\) a punto de ser campos más bajos que los de
están\(0.3 \: \text{ppm}\) a punto de ser campos más bajos que los de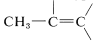 .
.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


