16.5: Reacciones Típicas de Adición de Carbonilo
- Page ID
- 73551
Pasamos ahora a discutir algunas reacciones de adición específicas de los grupos carbonilo de aldehídos y cetonas. No intentaremos proporcionar un extenso catálogo de reacciones, sino que intentaremos enfatizar los principios involucrados con reacciones especialmente importantes que son útiles en la síntesis.
Los reactivos de Grignard, los compuestos de organolitio y similares generalmente se agregan a aldehídos y cetonas rápida e irreversiblemente, pero lo mismo no es cierto para muchos otros reactivos; sus reacciones de adición pueden requerir catalizadores ácidos o básicos; los aductos pueden formarse reversiblemente y con relativamente desfavorables constantes de equilibrio. Además, los aductos iniciales pueden ser inestables y reaccionar adicionalmente por eliminación. (Te recomendamos que revises la Sección 15-4E para ver ejemplos de estos puntos.) Para organizar este gran número de reacciones de adición, hemos organizado las reacciones de acuerdo con el nucleófilo que se suma al carbono carbonilo. Los tipos de nucleófilos considerados aquí forman\(\ce{C-C}\),\(\ce{C-O}\),\(\ce{C-N}\),\(\ce{C}\) -halógeno\(\ce{C-S}\), y\(\ce{C-H}\) enlaces. Se da un resumen en la Tabla 16-4.
Cuadro 16-4: Reacciones de Adición de Aldehídos y Cetonas
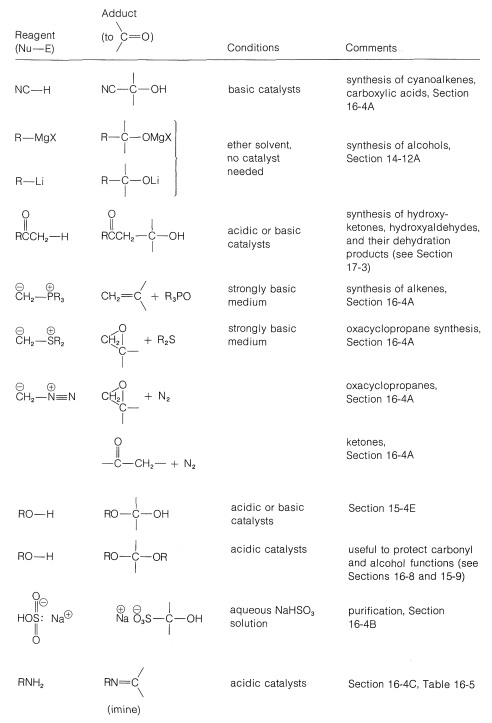
Adición de Nucleófilos de Carbono
Formación de cianohidrina
El cianuro de hidrógeno se suma a muchos aldehídos y cetonas para dar hidroxilnitrilos, generalmente llamados “cianohidrinas”:
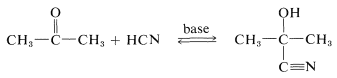
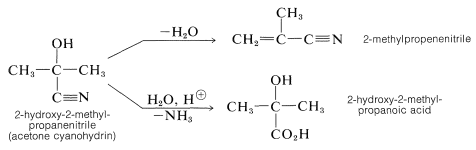
Los productos son útiles en síntesis, por ejemplo, en la preparación de cianoalquenos e hidroxiácidos:
Una característica importante de la formación de cianohidrina es que requiere un catalizador básico. En ausencia de base, la reacción no procede, o en el mejor de los casos es muy lenta. En principio, el catalizador básico puede activar el grupo carbonilo o el cianuro de hidrógeno. Con el ion hidróxido como base, una reacción que se espera es una adición reversible de hidróxido al grupo carbonilo:
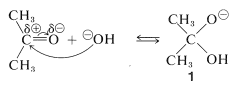
Sin embargo, tal adición no es probable que facilite la formación de cianhidrina porque representa una saturación competitiva del doble enlace carbonilo. De hecho, si la constante de equilibrio para esta adición fuera grande, un exceso de ion hidróxido podría inhibir la formación de cianohidrina atando la cetona como aducto\(1\).
El cianuro de hidrógeno en sí no tiene un par de electrones no compartidos sobre el carbono y no forma un enlace carbono-carbono con un carbono carbonilo. Sin embargo, una pequeña cantidad de una base fuerte puede activar el cianuro de hidrógeno convirtiéndolo en ion cianuro, que puede funcionar como un nucleófilo de carbono. A continuación se muestra una secuencia completa para la formación de cianohidrina:
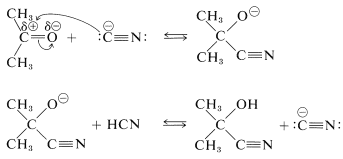
El segundo paso regenera el ion cianuro. Cada etapa de la reacción es reversible pero, con aldehídos y la mayoría de cetonas no impedidas, la formación de la cianhidrina es razonablemente favorable. En síntesis prácticas de cianhidrinas, es conveniente agregar un ácido fuerte a una mezcla de cianuro de sodio y el compuesto carbonilo, de manera que el cianuro de hidrógeno se genere in situ. La cantidad de ácido agregado debe ser insuficiente para consumir todo el ion cianuro, por lo que se mantienen condiciones suficientemente alcalinas para una rápida adición.
Adición de Reactivos Organometálicos (Ver Sección 14-12A)
Adición de Aniones Enolados (Ver Sección 17-3)
Adición de reactivos de iluro
Hay una serie de sustancias bastante interesantes para las cuales podemos escribir importantes estructuras dipolares de enlace de valencia del tipo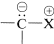 . El factor importante con estas estructuras es que el extremo negativo del dipolo es el carbono con un par de electrones no compartidos. El extremo positivo del dipolo puede ser de varios tipos de átomos o grupos, siendo el más habitual el azufre, el fósforo o el nitrógeno. Algunos ejemplos (cada uno escrito aquí como una única estructura de enlace de valencia dipolar) son:
. El factor importante con estas estructuras es que el extremo negativo del dipolo es el carbono con un par de electrones no compartidos. El extremo positivo del dipolo puede ser de varios tipos de átomos o grupos, siendo el más habitual el azufre, el fósforo o el nitrógeno. Algunos ejemplos (cada uno escrito aquí como una única estructura de enlace de valencia dipolar) son:
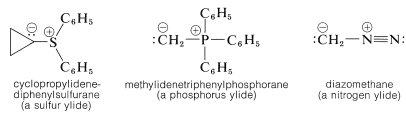
La nomenclatura sistemática de estas sustancias es engorrosa, pero han llegado a conocerse como iluros. La génesis de este nombre puede parecer oscura, pero es un intento de conciliar la presencia de un\(\ce{C-X}\)\(\sigma\) enlace, que es covalente y no polar como en los derivados alquilo, así como un enlace iónico como en los hal ides metálicos. De ahí, la combinación yl-lide. \(^2\)
Como cabría esperar de la estructura dipolar, los iluros pueden comportarse como nucleófilos de carbono para formar enlaces carbono-carbono por adición a los grupos carbonilo de aldehídos y cetonas:
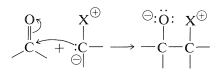
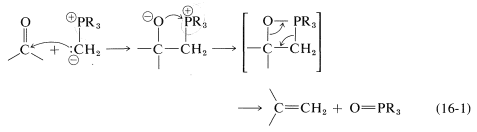
Sin embargo, el curso adicional de la reacción depende del tipo de iluro utilizado. En el caso de los iluros de fósforo, la reacción global equivale a una síntesis muy útil de alquenos por la transferencia de oxígeno a fósforo y carbono a carbono, como se resume en la Ecuación 16-1. Esto se llama la reacción de Witting:
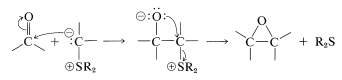
Las reacciones con los iluros de azufre proceden de manera diferente. Los productos son oxacilcopropanos (oxiranos), no alquenos. La etapa de adición avanza como con los iluros de fósforo, pero el oxígeno cargado negativamente del aducto dipolar desplaza entonces el grupo sulfonio como sulfuro neutro. Esta es una\(S_\text{N}2\) reacción intramolecular similar a la formación de oxaciclopropanos a partir de cloroalcoholes vecinales (Sección 15-11C):
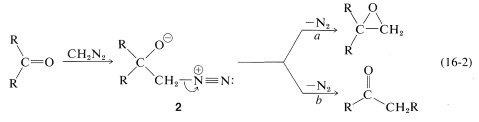
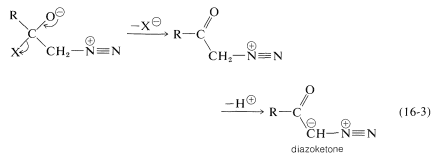
En cuanto a los iluros de nitrógeno, un reactivo útil de este tipo es el diazometano,\(\ce{CH_2N_2}\). El diaxometano puede reaccionar con los compuestos carbonílicos de diferentes maneras, dependiendo de lo que suceda con el aducto inicial\(2\). Los oxaciclopropanos se forman si el nitrógeno es simplemente desplazado (as\(\ce{N_2}\)) por el oxígeno (Trayectoria\(a\), Ecuación 16-2). Las cetonas de la estructura de carbono reordenada resultan si el nitrógeno es desplazado\(as \(\ce{N_2}\)) por\(\ce{R}^\ominus\) lo que se mueve hacia el\(\ce{CH_2}\) grupo (Trayectoria\(b\), Ecuación 16-2):
Las diazocetonas\(\ce{RCOCHN_2}\),, se forman si hay un buen grupo lábil, como el halógeno, en el carbonilo (Ecuación 16-3). En estas circunstancias el reactivo es un haluro de ácido, no un aldehído o cetona:
Adición de Nucleófilos de Oxígeno y Azufre
Alcoholes, Tioles, Agua
Ya hemos discutido adiciones de alcoholes y, por analogía, tioles\(\left( \ce{RSH} \right)\) a compuestos carbonílicos (ver Sección 15-4E). No vamos a repetir esta discusión aquí excepto para señalar que la adición de agua al grupo carbonilo de un aldehído es análoga a la formación de hemiacetal (Sección 15-4E) y es catalizada tanto por ácidos como bases:
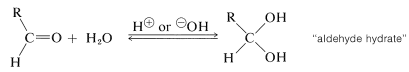
El equilibrio para la formación de hidratos depende tanto de factores estéricos como eléctricos. El metanal se\(99.99\%\) hidrata en solución acuosa, el etanal se\(58\%\) hidrata y la 2-propanona no se hidrata significativamente. Los hidratos rara vez se pueden aislar porque revierten fácilmente al aldehído parental. Los únicos hidratos cristalinos estables conocidos son aquellos que tienen grupos fuertemente electronegativos asociados con el carbonilo (ver Sección 15-7).
Adición de sulfito de hidrógeno (bisulfito) al compuesto de carbonilo
Varias adiciones de carbonilo tienen características similares a las de la formación de cianohidrina. Un ejemplo típico es la adición de hidrógeno sulfito de sodio, que procede fácilmente con una buena conversión en solución acuosa con la mayoría de los aldehídos, metil cetonas y cetonas cíclicas sin impedimentos para formar un enlace carbono-azufre. No se requiere catalizador porque el sulfito es un agente nucleofílico eficiente. Evidentemente, la etapa de adición implica el ion sulfito, no el ion sulfito de hidrógeno:
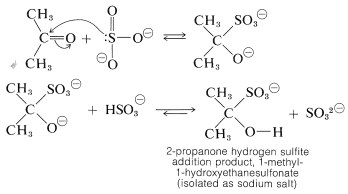
Los productos de adición a menudo son sólidos muy cristalinos que son insolubles en exceso de solución concentrada de hidrógeno sulfito de sodio. Ya sean solubles o insolubles, los productos de adición son útiles para separar compuestos carbonílicos de sustancias que no reaccionan con hidrogenosulfito de sodio.
Polimerización de Aldehídos
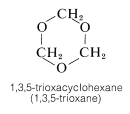
Una reacción estrechamente relacionada con la formación de acetales es la polimerización de aldehídos. Se obtienen polímeros tanto lineales como cíclicos. Por ejemplo, metanal en solución acuosa polimeriza a un polímero sólido de cadena lineal llamado paraformaldehído o “polioximetileno”:
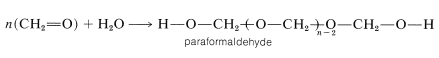
Este material, cuando se calienta fuertemente, vuelve al metanal; por lo tanto, es una fuente conveniente de metanal gaseoso. Cuando se calienta con ácido diluido, el paraformaldehído produce el trímero sólido, 1,3,5-trioxiciclohexano (mp\(61^\text{o}\)). También se conoce el tetrámero cíclico.
Los polímeros metanales de cadena larga se han vuelto muy importantes como plásticos en los últimos años. El bajo costo del paraformaldehído es altamente favorable en este sentido, pero la inestabilidad del material a temperaturas elevadas y ácidos diluidos impide su uso en plásticos. Sin embargo, la “" protección terminal "” de las cadenas de polioximetileno a través de la formación de ésteres o acetales produce un aumento notable en la estabilidad, y tales polímeros modificados tienen excelentes propiedades como plásticos.” Delrin (DuPont) es un polímero metanal estabilizado con resistencias excepcionales y facilidad de moldeo.
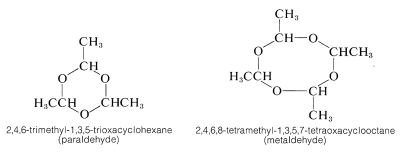
El etanal (acetaldehído) se polimeriza bajo la influencia de ácidos al trímero cíclico, “paraldehído”, y un tetrámero cíclico, “metaldehído”. El paraldehído se ha utilizado como un fármaco productor de sueño relativamente no tóxico (hipnótico). El metaldehído se utiliza como veneno para caracoles y babosas, “Snarol”. Las cetonas no parecen formar polímeros estables como los de los aldehídos.
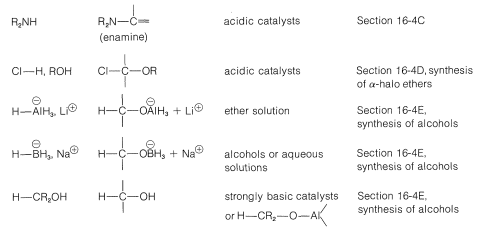
Nucleófilos de Nitrógeno
Reacciones de\(\ce{RNH_2}\) Derivados con Compuestos Carbonílicos
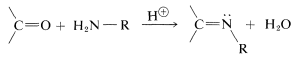
Una amplia variedad de sustancias con\(\ce{-NH_2}\) grupos reaccionan con aldehídos y cetonas mediante una secuencia de adición-eliminación para dar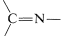 compuestos y agua. Estas reacciones suelen requerir catalizadores ácidos:
compuestos y agua. Estas reacciones suelen requerir catalizadores ácidos:
En el Cuadro 16-5 se resumen varias reacciones importantes de este tipo y la nomenclatura de los reactivos y productos.
Cuadro 16-5: Productos a partir de reacciones de compuestos carbonílicos con\(\ce{RNH_2}\) derivados
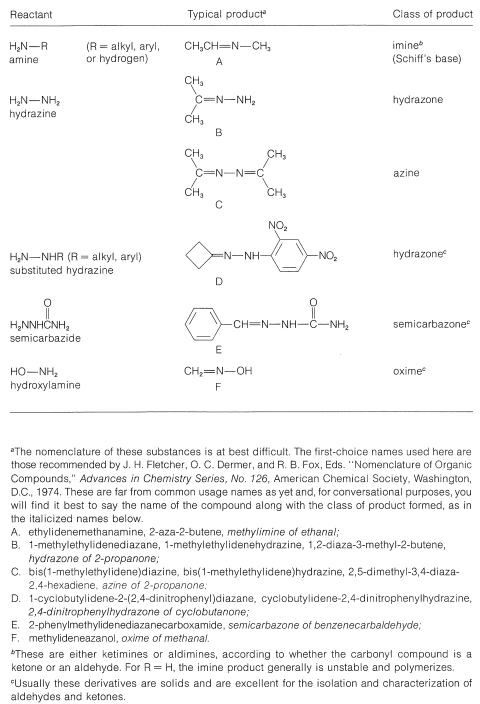
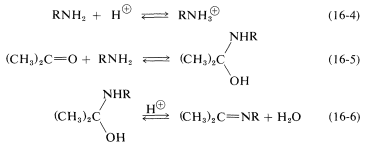
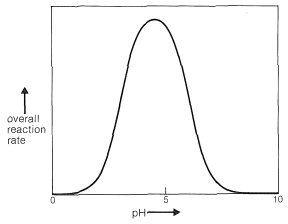
Claramente, si el par de electrones no compartidos sobre el nitrógeno de\(\ce{RNH_2}\) se combina con un protón, Ecuación 16-4, no puede atacar el carbono carbonilo para dar el aminoalcanol como en la Ecuación 16-5. Por lo que a alta concentración de ácido (pH bajo) esperamos que la velocidad y el equilibrio para la reacción general sean desfavorables. En ácido más diluido, la tasa recoge porque hay más libre\(\ce{RNH_2}\) en solución. La deshidratación del aminoalcanol (Ecuación 16-6) es catalizada por ácido; esta reacción normalmente es rápida a valores de pH menores a 3-4. Por lo tanto, la etapa lenta a pH\(<\) 4 es la adición del\(\ce{RNH_2}\) grupo carbonilo según la Ecuación 16-5. A medida que el pH se incrementa por encima de 4, la adición se vuelve progresivamente más rápida debido a\(\ce{RNH_2}\) que menos se ata como\(\ce{RNH_3^+}\). Sin embargo, entonces la etapa de deshidratación, Ecuación 16-6, disminuye en velocidad debido a que requiere un catalizador ácido. A pH 6 (recuerde que pasar de pH 4 a pH 6 es una disminución de 100 veces en la\(\ce{H}^\oplus\) concentración), la deshidratación es la etapa lenta, y a valores de pH más altos finalmente se vuelve demasiado lenta para dar una velocidad de reacción general útil. Se ha demostrado que esta secuencia de cambios en la velocidad y los equilibrios tiene en cuenta precisamente las curvas de tasa vs. pH como en la Figura 16-4.
La deshidratación de\(\ce{(CH_3)_2CHNR(OH)}\) to\(\ce{(CH_3)_2C=NR}\) implica la catálisis ácida de la misma manera que en la formación de acetal (Sección 15-4E):
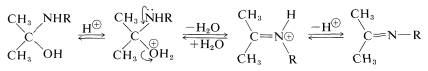
Adición de Amoníaco a Aldehídos
El amoníaco se agrega fácilmente a muchos aldehídos. Por ejemplo,
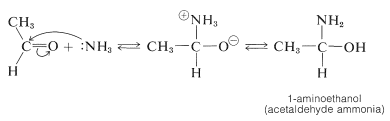
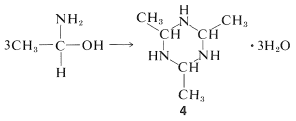
Los aductos aldehído-amoníaco generalmente no son muy estables. Se someten fácilmente a deshidratación y polimerización. El 1-aminoetanol, por ejemplo, da una composición de trímero cíclico\(\ce{C_6H_{15}N_3} \cdot 3 \ce{H_2O}\), mp\(97^\text{o}\), con estructura\(4\):
El metanal y el amoníaco reaccionan por un curso diferente con la formación de una sustancia conocida como “hexacetetramina”:
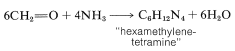
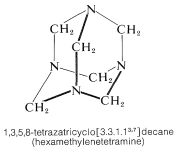
El producto es un sólido de alto punto de fusión (mp\(> \: 230^\text{o}\) d.) y su estructura ha sido establecida por difracción de rayos X (Sección 9-3). De hecho, fue la primera sustancia orgánica cuya estructura se determinó de esta manera. El alto punto de fusión está claramente asociado con la considerable simetría y rigidez de la estructura de la jaula:
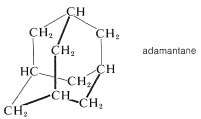
El correspondiente compuesto totalmente de carbono, adamantano (Sección 12-8), también tiene un alto punto de fusión\(\left( 268^\text{o} \right)\):
El tratamiento de la hexametilentetramina con ácido nítrico da la alta “ciclonita” explosiva, que a menudo se designa como RDX y fue ampliamente utilizada en la Segunda Guerra Mundial:
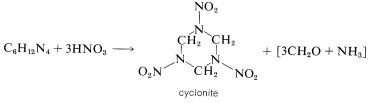
Entonces, no es necesario desperdiciar el metanal y el amoníaco que separan la estructura de la jaula durante la reacción con ácido nítrico. En la fabricación a gran escala de ciclonita, se utiliza una combinación de ácido nítrico, nitrato de amonio y anhídrido etanoico, lo que resulta en la plena utilización del metanal y el amoníaco:
\[\ce{C_6H_{12}N_4} + 4 \ce{HNO_3} + 2 \ce{NH_4NO_3} + 6 \ce{(CH_3CO)_2O} \rightarrow 2 \ce{C_3H_6O_6N_6} + 12 \ce{CH_3CO_2H}\]
Enaminas
Los compuestos amino secundarios del tipo se\(\ce{R_2N-H}\) agregan a los grupos carbonilo aldehído y cetona en una reacción catalizada por ácido de la misma manera que\(\ce{RNH_2}\) los compuestos, con una diferencia importante. El producto contiene la unidad estructural\(\ce{C=C-N}\) en lugar de\(\ce{C-C=N}\); y debido a que existe un doble enlace carbono-carbono, tal sustancia se llama enamina (alqueno\(+\) amina). Un ejemplo es:
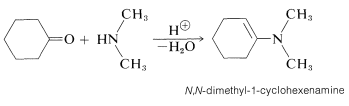
El curso de esta reacción se puede entender si notamos que la pérdida\(\ce{OH}\) del producto inicial conduce a un ion imonio,\(5\), que no puede perder un protón y formar un\(\ce{C=N}\) enlace:
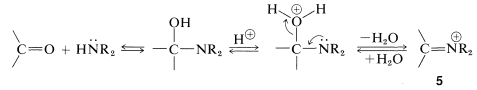
Sin embargo, si hay hidrógeno en un carbono unido al carbono imónico, es posible que dicho hidrógeno se pierda como protón con formación concurrente de la enamina neutra:
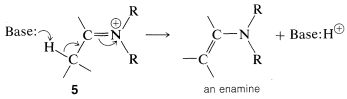
La formación de enamina, como muchas otras reacciones de adición de carbonilo, es fácilmente reversible, y el compuesto carbonilo se puede recuperar por hidrólisis con ácidos acuosos. Por esta razón, para obtener una buena conversión del compuesto carbonilo en enamina, generalmente es necesario eliminar el agua que se forma destilándola de la mezcla de reacción.
Las enaminas son intermedios sintéticos útiles para la formación de enlaces carbono-carbono, como discutiremos con mayor detalle en la Sección 17-4B.
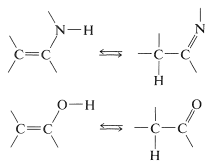
Las enaminas generalmente son inestables si hay hidrógeno sobre el nitrógeno. Se reordenan a la imine correspondiente. Este comportamiento es análogo al reordenamiento de los alquenoles a compuestos carbonílicos (Sección 10-5A):
Adición de haluro de hidrógeno a grupos carbonilo y reemplazo de carbonilo por halógeno
La adición de haluros de hidrógeno a grupos carbonilo normalmente es tan fácilmente reversible que impide el aislamiento de los productos de adición:
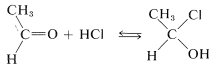
Sin embargo, muchos aldehídos reaccionan con alcoholes en presencia de un exceso de cloruro de hidrógeno para dar\(\alpha\) -cloro-éteres:
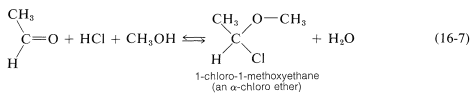
En la realización de síntesis de laboratorio de\(\alpha\) -cloro-éteres, se pasa cloruro de hidrógeno gaseoso a una mezcla del alcohol y aldehído. El agua no\(\ce{HCl}\) es útil porque el exceso de agua da un equilibrio desfavorable. \(\alpha\)-Los cloro-éteres son compuestos altamente reactivos que experimentan muy fácilmente, así\(S_\text{N}2\) como\(S_\text{N}1\)\(E1\) reacciones. Dos ejemplos sencillos, metoxiclorometano (clorometil metil éter) y clorometoxiclorometano (bis-clorometil éter), han sido sometidos a severas restricciones como resultado de pruebas que demuestran que tienen fuertes propiedades químicas carcinógenas.
La sustitución de la función carbonilo por dos cloros ocurre con pentacloruro de fósforo en éter:
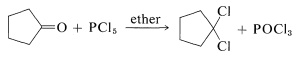
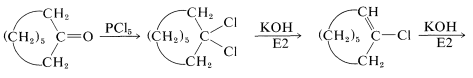
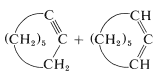
Esta reacción es útil junto con\(E2\) la eliminación para preparar haluros de alquenil, alenos y alquinos. Los haluros de cicloalquenil se preparan fácilmente, pero debido a la deformación angular no pueden aislarse los cicloalquinos y cicloalenos con menos de ocho átomos en el anillo (ver Sección 12-7):
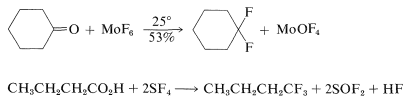
La sustitución de un grupo carbonilo por gema -fluorinas se\(^3\) puede lograr con hexafluoruro de molibdeno o tetrafluoruro de azufre. El tetrafluoruro de azufre convierte las funciones carboxilo en grupos trifluorometilo:
El hidruro como nucleófilo. Reducción de compuestos carbonílicos
Hidruros de Metal y Boro
En los últimos años, los hidruros inorgánicos como el hidruro de litio y aluminio\(\ce{LiAlH_4}\), y el borohidruro de sodio\(\ce{NaBH_4}\), se han vuelto extremadamente importantes como agentes reductores de compuestos carbonílicos. Estos reactivos tienen una utilidad considerable, especialmente con compuestos carbonílicos sensibles y caros. La reducción de ciclobutanona a ciclobutanol es un buen ejemplo, y notarás que la reacción neta es la adición de hidrógeno a través del doble enlace carbonilo,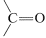 \(\overset{ 2 \left[ \ce{H} \right]}{\longrightarrow}\)
\(\overset{ 2 \left[ \ce{H} \right]}{\longrightarrow}\)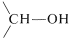 ,
,
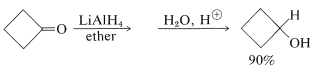
Con los hidruros metálicos, la etapa clave es la transferencia de un ion hidruro al carbono carbonilo de la sustancia que se está reduciendo.
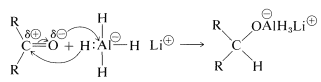
La transferencia de hidruro es análoga a la transferencia\(\ce{R}^\ominus\) de compuestos organometálicos a grupos carbonilo (Sección 14-12A).
El hidruro de litio y aluminio se maneja mejor como un reactivo de Grignard, porque es soluble en éter y es sensible tanto al oxígeno como a la humedad. (El hidruro de litio es insoluble en solventes orgánicos y no es un agente reductor efectivo para compuestos orgánicos). Los cuatro hidrógenos del aluminio se pueden utilizar:
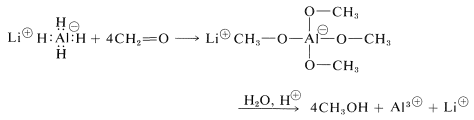
Los productos de reacción deben descomponerse con agua y ácido como con los complejos de Grignard. Cualquier exceso de hidruro de litio y aluminio se descompone por agua y un ácido con desprendimiento de hidrógeno:
\[\ce{LiAlH_4} + 2 \ce{H_2SO_4} \rightarrow \frac{1}{2} \ce{Li_2SO_4} + \frac{1}{2} \ce{Al_2(SO_4)_3} + 4 \ce{H_2}\]
El hidruro de litio y aluminio generalmente reduce los grupos carbonilo sin afectar los dobles enlaces carbono-carbono. Es, además, un buen agente reductor para grupos carbonilo de ácidos carboxílicos, ésteres y otros derivados ácidos, como se describirá en el Capítulo 18.
El borohidruro de sodio es un agente reductor más suave que el hidruro de litio y aluminio y reducirá los aldehídos y cetonas, pero no los ácidos ni los ésteres. Reacciona suficientemente lentamente con agua en solución neutra o alcalina para que reducciones que sean razonablemente rápidas se puedan llevar a cabo en solución acuosa sin hidrólisis apreciable del reactivo:
\[\ce{NaBH_4} + 4 \ce{CH_2=O} + 3 \ce{H_2O} \rightarrow 4 \ce{CH_3OH} + \ce{NaOB(OH)_2}\]
El borano (como\(\ce{BH_3}\) en tetrahidrofurano o sulfuro de dimetilo) es un agente reductor aún más suave que\(\ce{BH_4^+}\) para el grupo carbonilo de aldehídos y cetonas. Esta diferencia en la reactividad se puede utilizar con ventaja cuando es necesaria una reducción selectiva. Por ejemplo, el borohidruro reduce una cetona carbonilo más rápidamente que un doble enlace carbono-carbono, mientras que el borano reduce el doble enlace carbono-carbono más rápidamente que el carbonilo:
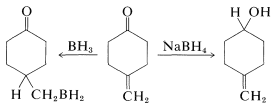
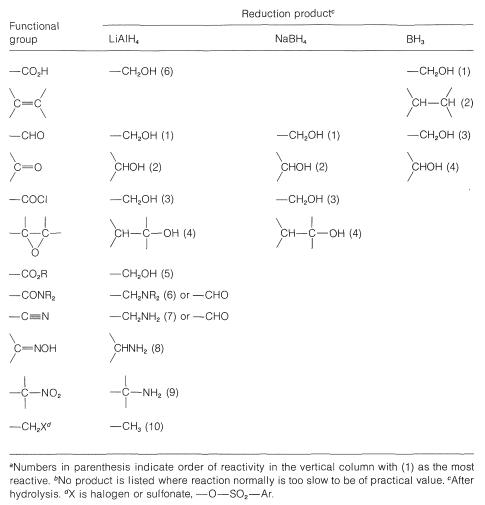
En el Cuadro 16-6 se presenta una comparación útil de las reactividades de boranos e hidruros metálicos hacia diversos tipos de enlaces múltiples.
Cuadro 16-6: Comparación de Productos y Reactividades de Grupos Funcionales para Reducción con Borano e Hidruros Metálicos\(^{a,b}\)
La reacción de Cannizzaro
Una reacción característica de los aldehídos sin\(\alpha\) hidrógenos es la autooxidación-reducción que experimentan en presencia de una base fuerte. Con el metanal como ejemplo,
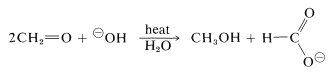
Si el aldehído tiene\(\alpha\) hidrógenos, otras reacciones suelen ocurrir más rápidamente.
El mecanismo de esta reacción, generalmente llamada la reacción de Cannizzaro,\(^4\) combina muchas características de otros procesos estudiados en este capítulo. La primera etapa es la adición reversible de ion hidróxido al grupo carbonilo:
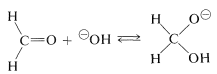
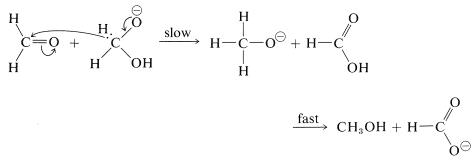
Un hidrógeno se puede transferir como ion hidruro a metanal desde el ion hidroxialcóxido, reduciendo así el metanal a metanol:
Reducción con Alcóxidos de Aluminio
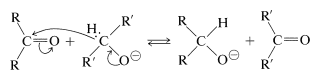
La transferencia de hidruro similar a la de la reacción de Cannizzaro también se puede lograr a partir de una\(\ce{C-H}\) agrupación en un ion alcóxido correspondiente a un alcohol primario o secundario, pero no terciario. Se espera que esta sea una reacción reversible, ya que los productos son otro alcóxido y otro compuesto carbonilo:
Para utilizar este proceso de equilibrio como método práctico de reducción se requieren condiciones bastante especiales. Es preferible usar un alcóxido de aluminio\(\ce{Al(OR)_3}\), en lugar de un alcóxido de sodio\(\overset{\oplus}{\ce{Na}} \overset{\ominus}{\ce{O}} \ce{R}\), para asegurar que la mezcla de reacción no sea demasiado básica. (Los compuestos carbonílicos, particularmente los aldehídos, son sensibles a bases fuertes). La reacción general puede ser escrita
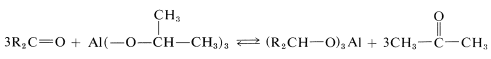
para lo cual el alcóxido se deriva del 2-propanol. La ventaja de este método es que la reacción puede ser conducida esencialmente hasta su finalización destilando la 2-propanona a medida que se forma. El producto de reducción puede obtenerse posteriormente por hidrólisis ácida del alcóxido de aluminio:
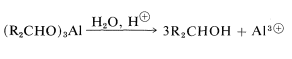
Reacciones Biológicas
Estos han sido discutidos ya en el contexto de las reacciones inversas - oxidación de alcoholes (Sección 15-6C).
\(^2\)Se pronuncia de diversas maneras como enfermo/id, yill/id, ill/ide, yill/ide. Las estructuras dipolares usualmente escritas para iluros son una representación sobresimplificada de la unión en estas sustancias.
\(^3\)Gem es una abreviatura de geminal (hermanado) y es una designación conversacional común para arreglos que tienen dos sustituyentes idénticos en un carbono.
\(^4\)El nombre de su descubridor, el mismo Cannizzaro que, en 1860, hizo una enorme contribución al problema de obtener pesos atómicos autoconsistentes (Sección 1-1).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


