18.6: Reacciones en el\(\alpha\) Carbons of Carboxylic Acids
- Page ID
- 72920
Halogenación
El bromo reacciona suavemente con los ácidos carboxílicos en presencia de pequeñas cantidades de fósforo para formar ácidos alfa-bromocarboxílicos (reacción de Hell-Volhard-Zelinsky):
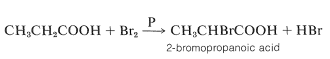
La reacción es lenta en ausencia de fósforo, cuya función parece ser formar tribromuro de fósforo, que luego reacciona con el ácido para dar el bromuro de acilo:
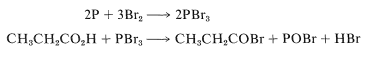
La formación del bromuro de acilo acelera la reacción porque la enolización catalizada por ácido del bromuro de acilo ocurre mucho más fácilmente que la enolización del ácido parental. El bromo probablemente reacciona con el enol del bromuro de acilo de la misma manera que reacciona con los enoles de las cetonas (Sección 17-2A).
La etapa final es la formación del\(\alpha\) -bromo ácido por intercambio de bromo entre el bromuro de\(\alpha\) -bromoacilo y el ácido parental; el bromuro de acilo, que es necesario para continuar la reacción, se regenera así:
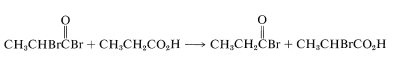
Esta reacción de bromación resulta exclusivamente en sustitución alfa y por lo tanto se limita a ácidos carboxílicos con\(\alpha\) hidrógenos. El cloro con trazas de fósforo reacciona de manera similar pero con menor especificidad general, debido a que la cloración simultánea por radicales libres puede ocurrir en todas las posiciones a lo largo de la cadena (como en la halogenación de hidrocarburos; ver Sección 4-6A).
Reacciones de sustitución\(\alpha\) de ácidos haloalcanoicos
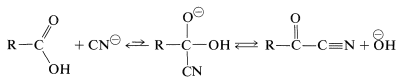
El halógeno de un ácido\(\alpha\) -haloalcanoico se reemplaza fácilmente por reactivos nucleofílicos tales como\(\ce{CN}^\ominus\),\(\ce{OH}^\ominus\),\(\ce{I}^\ominus\), y\(\ce{NH_3}\). Así, se puede preparar una variedad de adyuvantes carboxílicos\(\alpha\) sustituidos mediante reacciones que son análogas a la\(S_\text{N}2\) sustitución de haluros de alquilo:
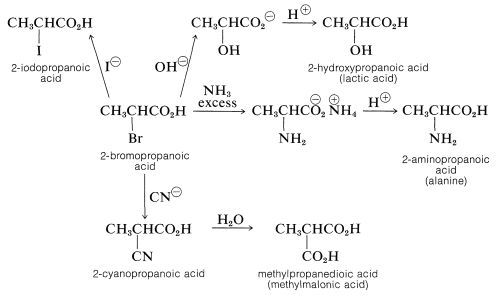
Se esperan reacciones de\(S_\text{N}2\) sustitución fácil de halógenos a partir de las características de atracción de electrones de la función carbonilo vecina, lo que debería hacer que el estado de transición para el ataque por un reactivo nucleofílico sea más favorable:
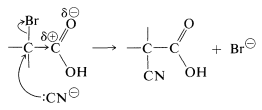
Quizás pueda parecer sorprendente que el carbono carboxilo no sea atacado por los agentes nucleofílicos, porque hemos enfatizado anteriormente la susceptibilidad de los grupos carbonilo a los reactivos nucleofílicos. Sin embargo, no resulta un producto estable a partir de la adición al grupo carbonilo por el tipo de reactivos considerados aquí. Así, con el ion cianuro la constante de equilibrio para la adición es desfavorable debido a la pérdida asociada de energía de estabilización del grupo carboxilo.
La\(S_\text{N}1\) reactividad de los ácidos\(\alpha\) -haloalcanoicos es particularmente baja. Esto es razonable porque la formación de un centro catiónico en el\(\alpha\) carbono debería ser difícil, debido al carácter positivo del carbono carbonilo. Además, se podría esperar poca ayuda, si alguna, a través de la deslocalización de electrones porque la estructura de enlace de valencia correspondiente tiene un oxígeno positivo de enlace simple:
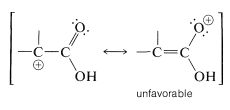
Consideraciones similares se aplican a las\(S_\text{N}1\)\(S_\text{N}2\) reacciones de\(\alpha\) -haloaldehídos y\(\alpha\) -halo cetonas (Sección 17-2C).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


