18.5: Descarboxilación de Ácidos Carboxílicos
- Page ID
- 72935
La descarboxilación de\(\ce{RCO_2H}\) para dar\(\ce{RH}\) y\(\ce{CO_2}\) puede calcularse a partir de las energías de enlace y la energía de estabilización del grupo carboxilo a tener\(\Delta H^0 = -7 \: \text{kcal mol}^{-1}\). Esto no quiere decir que la reacción vaya con facilidad. Se requieren características estructurales especiales. Los ácidos carboxílicos alifáticos simples no pierden dióxido de carbono al calentarse, pero cuando hay grupos fuertemente atrayentes de electrones unidos al\(\alpha\) carbono, la descarboxilación a menudo procede fácilmente a\(100\) -\(150^\text{o}\). Los ejemplos incluyen
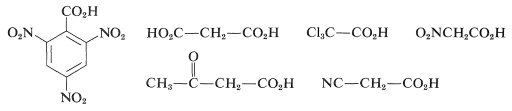
El ácido 3-butenoico también se somete a descarboxilación pero tiene que calentarse por encima de\(200^\text{o}\):
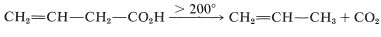
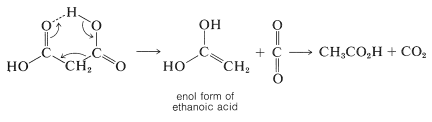
Los mecanismos de descarboxilación térmica probablemente no son los mismos para todos los casos, pero cuando el ácido tiene una función de doble enlace como\(\ce{O=C}\),\(\ce{N=C}\),\(\ce{O=N}\), o\(\ce{C=C}\) unido al\(\alpha\) carbono, entonces parece ocurrir un proceso de eliminación cíclica. Para el ácido propanodioico el proceso es
Los radicales carboxilato se pueden generar de varias maneras. Una es la descomposición térmica de los peróxidos de diacilo, que son compuestos con\(\ce{O-O}\) enlaces bastante débiles:
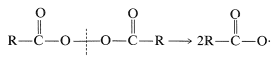
Otro método implica la electrólisis de soluciones de carboxilato de sodio o potasio, conocida como electrólisis de Kolbe, en la que los radicales carboxilato se forman por transferencia de un electrón desde el ion carboxilato al ánodo. La descarboxilación puede ocurrir simultáneamente con, o después de, la formación de radicales carboxilato, conduciendo a radicales hidrocarbonados, que posteriormente dimerizan:
.png)
Un ejemplo es

La descarboxilación de las sales de plata de ácidos carboxílicos en presencia de bromo o cloro, la reacción de Hunsdiecker, a menudo es útil para la síntesis de haluros de alquilo:
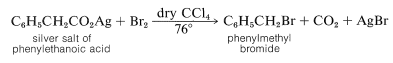
El mecanismo de esta reacción parece implicar la formación de radicales carboxilato a través de la descomposición de un intermedio acil-hipobrómico,\(12\):
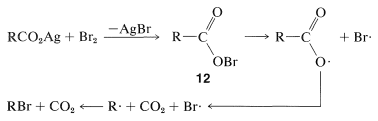
La reacción Hunsdiecker presenta ciertas desventajas, principalmente porque requiere el uso de la sal pura de plata seca, que a menudo es difícil de preparar. Con algunos ácidos, sin embargo, se pueden obtener excelentes resultados utilizando el propio ácido y un exceso de óxido mercúrico rojo en lugar de la sal de plata.
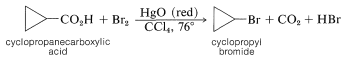
o calentando el ácido con tetraetanoato de plomo\(\ce{Pb(O_2CCH_3)_4}\), y yodo,
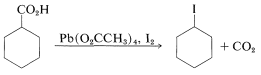
Se puede lograr una reacción de descarboxilación algo similar con formación de un alqueno calentando un ácido carboxílico con tetraetanoato de plomo\(\ce{Pb(O_2CCH_3)_4}\),, en presencia de una cantidad catalítica de\(\ce{Cu(OCH_3)_2}\). Un ejemplo útil es
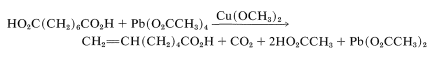
Hay alguna descarboxilación competidora del ácido etanoico, pero las conversiones en este tipo de reacción suelen ser buenas. Los pasos clave en la reacción probablemente son el intercambio de grupos ácido carboxílico sobre el plomo tetravalente, la escisión del\(\ce{Pb-O}\) enlace para dar el radical carboxilato, la descarboxilación, la oxidación del radical alquilo por\(\ce{Cu}\) (II) para dar el catión\(\left[ \ce{R} \cdot + \ce{Cu} (II) \rightarrow \ce{R}^\oplus + \ce{Cu} (I) \right]\), y finalmente la pérdida de un protón para formar el alqueno.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


