18.11: Ácidos dicarboxílicos
- Page ID
- 72940
Los ácidos en los que hay dos grupos carboxilo separados por una cadena de más de cinco átomos de carbono en\(\left( n > 5 \right)\) su mayor parte tienen propiedades poco excepcionales, y los grupos carboxilo se comportan más o menos independientemente entre sí.
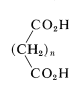
Sin embargo, cuando los grupos carboxilo están más cerca, las posibilidades de interacción aumentan; nos interesará principalmente dichos ácidos. En el Cuadro 18-4 se enumeran varios ácidos dicarboxílicos importantes junto con sus propiedades físicas, métodos de fabricación y usos comerciales.
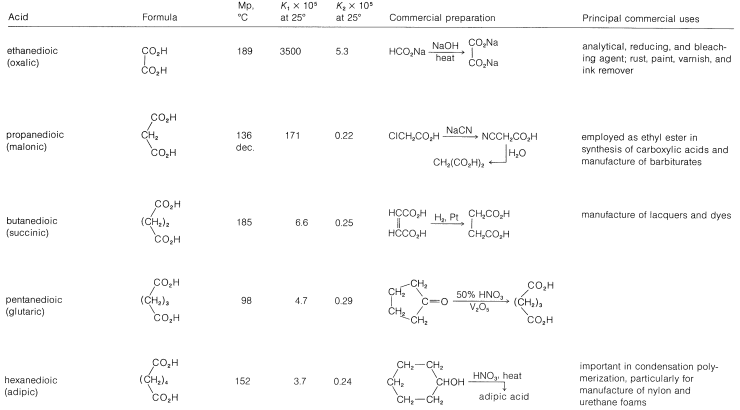
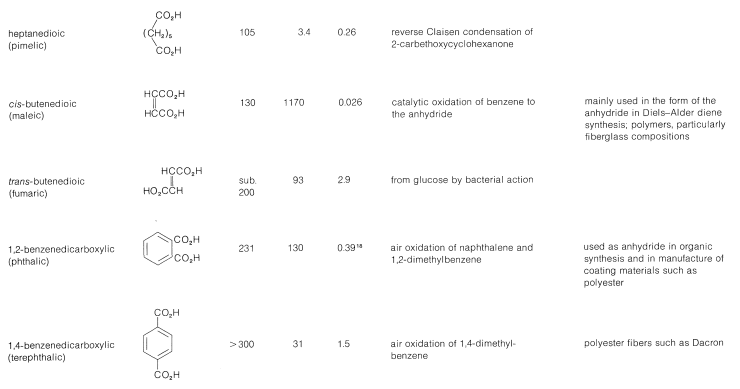
Cuadro 18-4: Ácidos dicarboxílicos
Propiedades ácidas de los ácidos dicarboxílicos
Se espera que el efecto inductivo de un grupo carboxilo mejore la acidez del otro. En el Cuadro 18-4 vemos que la fuerza ácida de los ácidos dicarboxílicos, medida por la primera constante de disociación ácida\(K_1\), es mayor que la del ácido etanoico\(\left( K_\text{a} = 1.5 \times 10^{-5} \right)\) y disminuye al aumentar el número de enlaces entre los dos grupos carboxilo. La segunda constante de disociación ácida\(K_2\),, es menor que\(K_\text{a}\) para el ácido etanoico (con la excepción del ácido oxálico) porque es más difícil eliminar un protón bajo la atracción electrostática del anión carboxilato cercano (ver Sección 18-2C).
Comportamiento Térmico de Ácidos Dicarboxílicos
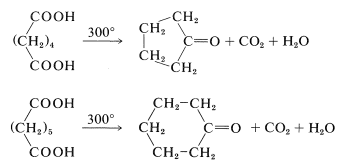
Las reacciones que ocurren cuando los ácidos dicarboxílicos se calientan dependen críticamente de la longitud de la cadena que separa los grupos carboxilo. La ciclación suele ser favorecida si se puede formar un anillo de cinco o seis miembros sin esfuerzo. Así, los ácidos hexanodioico y heptanodioico se descarboxilan y ciclan a ciclopentanona y ciclohexanona, respectivamente:
Los ácidos butanodioico y pentanodioico toman un curso diferente. En lugar de formar las cetonas cíclicas coladas, ciclopropanona y ciclobutanona, ambos ácidos forman anhídrido cíclicos que tienen anillos de cinco y seis miembros, respectivamente. Los ácidos 1,2-bencenodicarboxílico (ftálico) y cis-1,4-butenodicarboxílico (maleico) se comportan de manera similar:
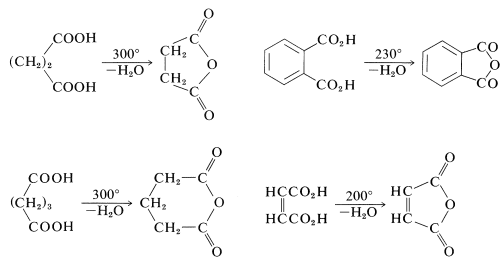
Debido a sus cadenas cortas, los ácidos propanodioico y etanodioico simplemente se descarboxilan cuando se calientan (Sección 18-4):

Imidas de ácidos dicarboxílicos
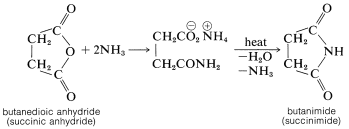
El anhídrido cíclico del ácido butanodioico reacciona con amoníaco, como puede esperarse para un anhídrido típico; pero el producto, cuando se calienta fuertemente, forma una imida cíclica (butanimida):
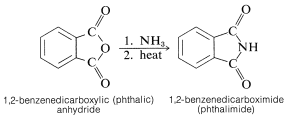
El anhídrido 1,2-bencenodicarboxílico (ftálico) se comporta de manera similar, dando 1,2-bencenodicarboximida (ftalimida):
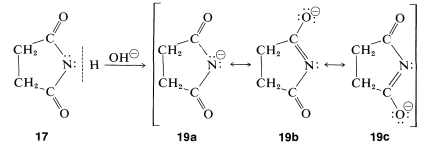
A diferencia de las aminas, las imidas no tienen propiedades básicas en solución acuosa; el par de electrones de nitrógeno está parcialmente deslocalizado sobre los grupos carbonilo, como se indica por\(17a\) to\(17c\). Esta estabilización se pierde si se agrega un protón al nitrógeno para dar el ácido conjugado,\(18\):
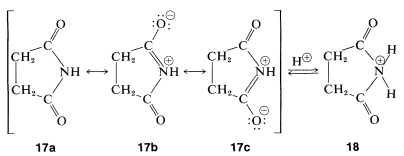
Las imidas son, de hecho, bastante ácidas y se disuelven fácilmente en soluciones de hidróxido de metales alcalinos para dar sales. Al igual que los ácidos carboxílicos y los compuestos 1,3-dicarbonilo, las imidas son ácidas principalmente porque la estabilización del anión es mayor que la del ácido. Esto se puede ver comparando las estructuras de resonancia que se pueden escribir para la imida,\(17\), con las del anión,\(18\). Separación de carga positiva y negativa, como en Estructuras\(17b\) y\(17c\), aumenta la energía de tales estructuras. No hay separación de carga en el anión; así\(19b\) y\(19c\) son más importantes con respecto a su híbrido que lo son\(17b\) y\(17c\) a su híbrido. (Tal vez desee revisar el argumento correspondiente a la acidez de los ácidos carboxílicos, Sección 18-2A.)
Las sales de imidas son útiles en síntesis, como se describe en la Sección 23-9D.
La condensación de Dieckmann
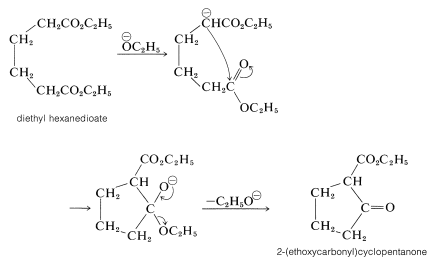
Los ésteres de la mayoría de los ácidos dicarboxílicos, excepto los ésteres propanodioicos, experimentan condensación de Claisen de la misma manera que los ésteres de ácidos monocarboxílicos (ver\ (\ alfa\) Carbones de derivados de ácidos carboxílicos” href=” /Librerías/Química orgánica/libro:_básico_principios_de_orgánico_química_ (Roberts_and_ Caserio) /18:_ácidos_carboxílicos_y_su_derivativos/18.09:_reacciones_at_el/ (/alpha/) _carbons_of_ácido_carboxilic_derivados #18 -8B_The_Claisen_Condensación">Sección 18-8B). Sin embargo, cuando se puede formar un anillo de cinco o seis miembros sin tensión, puede tener lugar una condensación intramolecular de Claisen, llamada condensación de Dieckmann, que daría como resultado la formación de un\(\beta\) -ceto-éster cíclico:
La reacción de aciloína
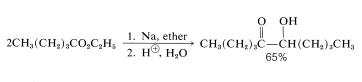
Un método útil para formar enlaces carbono-carbono implica la reducción de ésteres con sodio metálico en disolventes apróticos tales como éter o benceno y se llama reacción de aciloína:
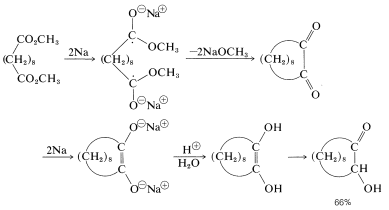
Esta interesante reacción es especialmente útil para la síntesis de compuestos de anillos medianos y grandes a partir de ésteres dicarboxílicos, y es efectiva para tamaños de anillo que no pueden hacerse por la condensación o descarboxilación de Dieckmann (Sección 18-10B). Los aniones radicales formados por la adición de sodio a los grupos éster parecen ser los intermedios clave para la formación de enlaces carbono-carbono. Así, para el decanodioato de dimetilo:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


