18.10: Reacciones de ácidos carboxílicos insaturados y sus derivados
- Page ID
- 72930
Los ácidos carboxílicos insaturados del tipo\(\ce{RCH=CH(CH_2)}_n \ce{COOH}\) suelen exhibir las propiedades características de los dobles enlaces aislados y los grupos carboxilo aislados cuando\(n\) son grandes y los grupos funcionales están muy separados. Como era de esperar, el comportamiento excepcional se encuentra más comúnmente cuando los grupos están lo suficientemente cercanos entre sí para interactuar fuertemente, como en\(\alpha\),\(\beta\) -ácidos insaturados,\(\ce{R} \overset{\beta}{\ce{C}} \ce{H=} \overset{\alpha}{\ce{C}} \ce{CO_2H}\). Destacaremos aquellas propiedades que sean excepcionales en la siguiente discusión.
Migración del Doble Enlace
En presencia de base fuerte\(\alpha\), los ácidos carboxílicos\(\beta\) - y\(\beta\),\(\gamma\) -insaturados tienden a interconvertirse por migración del doble enlace:

Los derivados éster\(\ce{RCH=CH-CH_2COOR'}\), y los correspondientes aldehídos y cetonas insaturados\(\ce{RCH=CH-CH_2COR'}\), son mucho más propensos a este tipo de reordenamiento que los ácidos.
Hidratación y adición de bromuro de hidrógeno
Al igual que los alquenos\(\alpha\), los dobles enlaces de los ácidos\(\beta\) insaturados pueden ser bromados, hidroxilados, hidratados e hidrobromados, aunque las reacciones a menudo son relativamente lentas. En la adición de reactivos asimétricos la dirección de adición es opuesta a la observada para los alquenos (anti-Markovnikov). Así, el ácido propenoico (acrílico) añade bromuro de hidrógeno y agua para formar los ácidos 3-bromo y 3-hidroxipropanoico:
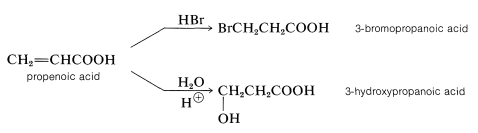
Estas adiciones son análogas a la adición de halógenos y ácidos halógenos al 1,3-butadieno (Sección 13-2). En la primera etapa, se transfiere un protón al oxígeno carbonilo. El ácido conjugado resultante puede considerarse como un híbrido de resonancia de estructuras\(16a\) -\(16d\):
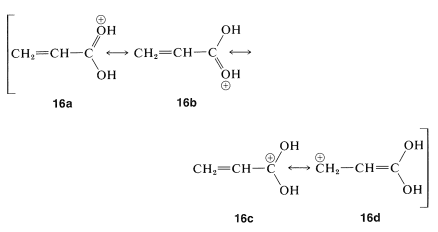
En el segundo paso, un nucleófilo (como\(\ce{Br}^\ominus\) o una molécula de agua) ataca un carbono deficiente en electrones del híbrido\(16\). El ataque al carbono carboxilo puede ocurrir pero no conduce a un producto estable. El ataque del nucleófilo al\(\beta\) carbono, sin embargo, produce la forma enol del ácido\(\beta\) sustituido, que luego se convierte rápidamente en el ácido carboxílico normal:
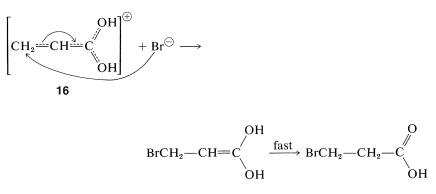
Formación de lactona
Cuando el doble enlace de un ácido insaturado está más abajo de la cadena carbonada que entre las posiciones alfa y beta, la llamada “adición conjugada” no es posible. Sin embargo, el doble enlace y el grupo carboxilo interactúan frecuentemente en presencia de catalizadores ácidos porque el carbocatión que resulta de la adición de un protón al doble enlace tiene un nucleófilo incorporado (el grupo carboxilo), que puede atacar el centro catiónico para formar un éster cíclico llamado a lactona.
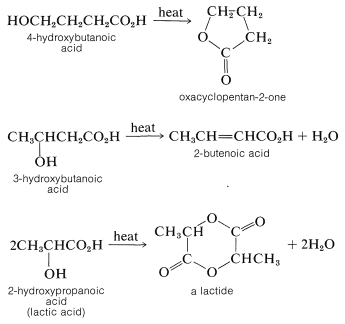
La formación de lactona solo ocurre fácilmente por este mecanismo cuando se puede formar un anillo de cinco o seis miembros:
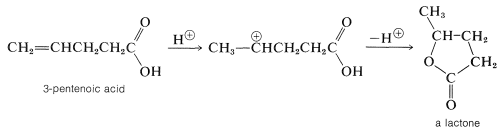
Las lactonas de cinco o seis miembros también se forman por esterificación interna cuando se calientan o bien\(\gamma\)\(\delta\) hidroxiácidos. En condiciones similares, los\(\beta\) -hidroxiácidos se deshidratan a ácidos\(\beta\) insaturados\(\alpha\), mientras que los\(\alpha\) -hidroxiácidos se someten a esterificación bimolecular a sustancias con anillos de dilactona de seis miembros llamados lactidas:
Más sobre Michael Addition
Los ejemplos anteriores de adición a los dobles enlaces de ácidos carboxílicos insaturados implican todos activación por una especie electrófila tal como\(\ce{H}^\oplus\). La adición de conjugados también puede ocurrir por ataque nucleofílico sobre derivados ácidos, siendo la más importante la adición de Michael catalizada por bases (Sección 17-5B) y la adición 1,4-de compuestos organometálicos (Sección 14-12D). En todas estas reacciones un agente nucleofílico, generalmente un carbanión, ataca el doble enlace de un compuesto\(\alpha\),\(\beta\) -insaturado en el que el doble enlace está conjugado con, y activado por, un grupo insaturado fuertemente electronegativo (como\(\ce{-CN}\)\(\ce{-NO_2}\),, etc.). En la adición de Michael, el carbanión suele ser una sal enolada.
La reacción global se ilustra aquí mediante el ejemplo específico de la adición de propanodioato de dietilo (malonato de dietilo) a 3-fenilpropenoato de etilo (cinamato de etilo):
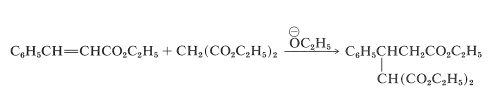
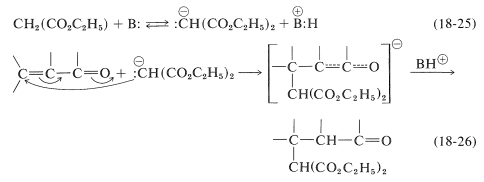
El mecanismo de este tipo de transformación, con propanodioato de dietilo como adición, se describe en las Ecuaciones 18-25 y 18-26. El catalizador básico requerido para la adición de Michael (aquí simbolizado como\(\ce{B:}\)) sirve formando el anión correspondiente:
Se puede usar una variedad de agentes nucleofílicos; propanodinitrilo, ésteres de 3-oxobutanoato y ésteres de cianoetanoato, todos forman carbaniones relativamente estables y funcionan bien en las reacciones de adición de Michael. Obviamente, si el carbanión es demasiado estable, tendrá poca o ninguna tendencia a atacar el doble enlace del\(\alpha\) derivado de ácido\(\beta\) insaturado.
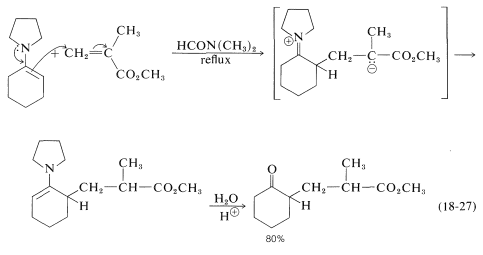
Las enaminas (Secciones 16-4C y 17-4B) son excelentes adiciones en muchas reacciones de tipo Michael. Un ejemplo se proporciona mediante la adición de\(\ce{N}\) - (1-ciclohexenil) -azaciclopentano a 2-metilpropanoato de metilo:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


