19.6: La Convención R, S para Designación de Configuraciones Estereoquímicas
- Page ID
- 73021
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Existen ciertas desventajas en el\(D\)\(L\) sistema que utiliza fórmulas de proyección Fischer para denotar la configuración alrededor de un centro quiral, y ya hemos visto cómo surge la ambigüedad en el caso de los ácidos tartáricos (Sección 19-5). Una forma más sistemática de denotar la configuración que eventualmente puede reemplazar al\(L\) sistema\(D\), al menos para compuestos simples, se conoce como la convención\(R\),\(S\) o Cahn-Ingold Prelog, después de sus originadores.
Para denotar la configuración de un centro quiral por la\(S\) convención\(R\), a los grupos en el centro se les asigna un orden de precedencia de acuerdo con un conjunto específico de reglas basadas en números atómicos. Supongamos que un átomo de carbono está unido a cuatro sustituyentes diferentes, que designaremos\(A\)\(B\),\(C\),,\(D\) y y a los que asignamos las siguientes secuencias prioritarias:\(A\) antes\(B\) antes\(C\) antes\(D\). Si ahora vemos la disposición de\(A\)\(B\), y\(C\) desde el sitio alejado del sustituyente de menor prioridad\(D\), como se muestra en la Figura 19-6, y la secuencia resulta estar\(A \rightarrow B \rightarrow C\) en el sentido de las agujas del reloj, entonces se dice la configuración ser\(R\). Si la secuencia\(A \rightarrow B \rightarrow C\) ocurre en sentido contrario a las agujas del reloj, la configuración es\(S\). Los símbolos\(R\) y\(S\) se toman de las palabras latinas recto y siniestro, significando derecha e izquierda, respectivamente.

La comprensión de\(R\) y\(S\) es simple; los problemas están en asignar las secuencias prioritarias para los sustituyentes reales. Las reglas siguen:
1. Se da prioridad a los átomos sustituyentes que tienen el mayor número atómico. Esto significa que cuatro átomos diferentes dispuestos tetraédricamente alrededor del centro quiral tienen una secuencia prioritaria que disminuye con el número atómico decreciente. Por ejemplo, la secuencia entre los halógenos es\(\ce{I} > \ce{Br} > \ce{Cl} > \ce{F}\), y Estructura\(5\) (mostrada aquí en perspectiva y en proyección) por lo tanto tiene la\(R\) configuración:
.jpg)
Para sustituyentes más complejos, la prioridad está determinada por el número atómico del primer átomo unido. La secuencia refleja\(\ce{CH_3S} > \ce{CH_3O} > \ce{NH_2} > \ce{CH_3} > \ce{H}\) así el hecho de que el número atómico disminuye en el orden\(\ce{S} > \ce{O} > \ce{N} > \ce{C} > \ce{H}\). La estructura\(6\) en consecuencia tiene la\(S\) configuración:
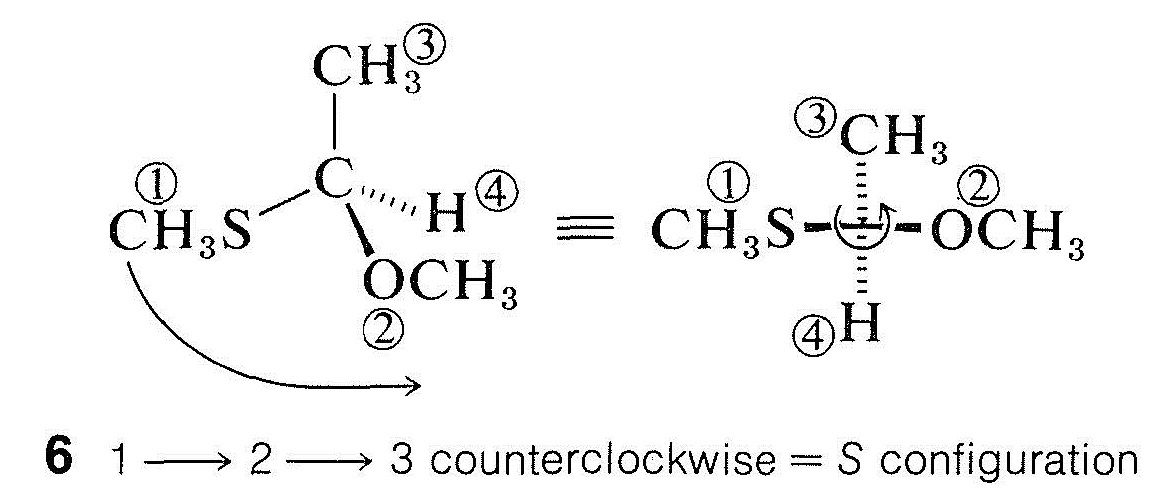
2. Los primeros átomos en dos o más sustituyentes suelen ser idénticos, en cuyo caso es necesario explorar más a fondo y comparar los números atómicos de los segundos átomos unidos. Se da precedencia al sustituyente con un segundo átomo de mayor número atómico. Por ejemplo, en 2-butanol,\(\ce{CH_3CH(OH)CH_2CH_3}\), dos de los grupos en el átomo quiral tienen carbono como primer átomo. Por lo tanto, debemos comparar los otros átomos unidos a estos dos carbonos. Es conveniente representar la disposición en el átomo quiral como se muestra en\(7\), donde los primeros átomos se muestran unidos al centro quiral y los segundos átomos se enumeran en su orden de prioridad; así,\(\left( \ce{C}, \: \ce{H}, \: \ce{H} \right)\) para etilo y\(\left( \ce{H}, \: \ce{H}, \: \ce{H} \right)\) para metilo:

Cuando comparamos\(\left( \ce{H}, \: \ce{H}, \: \ce{H} \right)\) con\(\left( \ce{C}, \: \ce{H}, \: \ce{H} \right)\) in\(7\), le damos prioridad al etilo sobre el metilo porque el carbono tiene un número atómico mayor que el hidrógeno. \(7\)Por lo tanto, la configuración debe ser\(S\).
3. Los enlaces dobles y triples se tratan como si tuvieran enlaces simples duplicados o triplicados. Así un grupo carbonilo,_-_Copy.jpg) , se trata como si fuera
, se trata como si fuera.jpg) donde los símbolos entre paréntesis representan los átomos duplicados.
donde los símbolos entre paréntesis representan los átomos duplicados.
Veamos cómo funciona esto para 3-cloro-1-pentino,\(8\):
.jpg)
La secuencia prioritaria del primer átomo es\(\ce{Cl} > \ce{C}\) y\(\ce{C} > \ce{H}\). Ahora necesitamos ordenar\(\ce{-CH_2CH_3}\) y\(\ce{-C \equiv CH}\) y, al hacer esto, comparamos los tres átomos unidos al primer carbono del grupo etilo\(\left( \ce{C}, \: \ce{H}, \: \ce{H} \right)\) con los tres unidos al primer carbono del grupo etinilo\(\left[ \ce{C}, \: \left( \ce{C} \right), \: \left( \ce{C} \right) \right]\). Sobre esta base, el etinilo viene por delante del etilo, y la secuencia general es\(\ce{Cl} > \ce{C \equiv CH} > \ce{CH_2CH_3} > \ce{H}\), por lo que\(8\) tendrá la\(S\) configuración.
Las reglas de secuencia descritas hasta ahora pueden ser utilizadas sin ambigüedad en la mayoría de los ejemplos que probablemente conozcamos. Lo importante a recordar es mirar el tipo de átomos unidos en la medida de lo necesario. Supongamos que tenemos que comparar el grupo aldehído\(\ce{-CH=O}\),, con el grupo dimetoximetilo,\(\ce{CH(OCH_3)_2}\). Los primeros átomos son iguales\(\left( \ce{C} \right)\), los segundos átomos son los mismos\(\left[ \ce{O}, \: \left( \ce{O} \right), \: \ce{H} \right]\), y la diferencia llega al nivel del tercer átomo donde estamos comparando pares solitarios (prioridad cero) con carbonos. Así\(\ce{-CH(OCH_3)_2}\), supera\(\ce{-CH=O}\).
La comparación de grupos como isopropilo y etenilo es más difícil y requiere saber cuál es la convención cuando tenemos que ir al otro extremo de un doble enlace. Una manera útil de escribir estos grupos es la siguiente:

Ponemos al etenilo por delante del isopropilo porque\(\left[ \left( \ce{C} \right), \: \ce{H}, \: \ce{H} \right]\) tiene prioridad sobre\(\left( \ce{H}, \: \ce{H}, \: \ce{H} \right)\). Es importante entender que el carbono no duplicado se considera conectado al carbono duplicado así como a los dos hidrógenos al llegar al patrón de conexión\(\left( \left( \ce{C} \right), \: \ce{H}, \: \ce{H} \right)\).
El mismo tipo de lógica conduce a la siguiente secuencia:

En el Cuadro 19-1 se da una lista más completa de prioridades entre grupos. Será un buen ejercicio pasar por esta lista y elaborar cómo se establecen las prioridades.
Tabla 19-1: Algunos grupos comunes en orden de preferencia creciente de regla de secuencia

Si está presente más de un centro quiral, la configuración en cada uno se especifica por el símbolo\(R\) o\(S\) junto con el número del átomo quiral. Así, se sabe que la configuración del ácido\(\left( + \right)\) -tartárico es la designada en el nombre\(\left( 2R,3R \right)\) - ácido\(\left( + \right)\) tartárico:

El\(S\) sistema\(R\), es bastante general y tiene muchas ventajas (y algunas desventajas) en comparación con la\(D\),\(L\) notación para moléculas simples. Para los diastereómeros, proporciona notaciones mucho más claras que meso, eritro\(^1\) y treo\(^1\) que se han usado durante muchos años para designar las configuraciones de diastereómeros aquirales y quirales que tienen dos átomos de carbono quirales:

El\(S\) sistema\(R\), se puede utilizar para designar la configuración de una molécula sin carbonos quirales pero con un centro quiral como, por ejemplo, un 1,2-dieno quiral (Sección 13-5A). Para hacer esto para un 1,2-dieno, la molécula se dibuja mejor en proyección, mirando a lo largo del\(\ce{C=C=C}\) vínculo con el grupo de mayor rango al frente. Los bonos en la retaguardia se proyectarán entonces en\(90^\text{o}\) a los lazos de los grupos de enfrente. Para un 1,2-dieno, ab\(\ce{C=C=C}\) xy, donde es el grupo de mayor rango, las proyecciones enantioméricas posibles son:

Ahora determinamos la prioridad de los grupos y luego asignamos las configuraciones\(R\) y\(S\) como se muestra, siempre que el grupo de mayor rango esté al frente y a\(>\) b y x\(>\) y. Al proceder de esta manera, es importante reconocer que no importa cuál sea la prioridad del grupo b basado en el número atómico, b siempre supera a un grupo trasero para que la secuencia de prioridad sea a\(\rightarrow\) b\(\rightarrow\) x con \(R\)en sentido horario y\(S\) antihorario.
\(^1\)Los prefijos eritro y treo se utilizan para configuraciones de compuestos con dos carbonos quirales diferentemente sustituidos que tienen grupos similares en cada carbono. Si en la fórmula de proyección de Fischer los grupos similares están del mismo lado, la configuración es eritro. Si los grupos similares están en lados opuestos, la configuración es treo.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


