21.2: Características de los enlaces covalentes simples
- Page ID
- 72841
El tipo de enlace más simple es el que existe entre átomos univalentes en moléculas diatómicas, tales como\(\ce{H_2}\)\(\ce{F_2}\),, y así sucesivamente. En la fase gaseosa las moléculas están en rápido movimiento, colisionando entre sí y con las paredes del contenedor. Los átomos vibran uno con respecto al otro, y las moléculas también tienen energía rotacional. A pesar de esta actividad, podemos asignar una distancia de enlace de equilibrio promedio\(\left( r_e \right)\) y una energía de enlace promedio\(\left( D_e \right)\) para moléculas normales no excitadas. A partir de los cálculos ab initio (Sección 6-6), se aprende que la energía de una\(\ce{H_2}\) molécula es función de\(r\), la distancia entre los hidrógenos, como se muestra en la Figura 21-1.
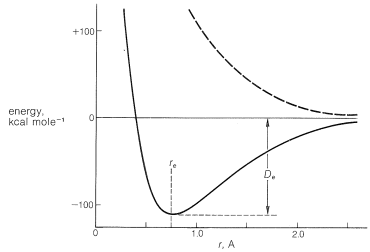
Cuando se reduce la distancia\(r_e\), la energía aumenta muy rápidamente debido a la repulsión internuclear. A medida que aumenta la separación entre los átomos, la energía del sistema aumenta más lentamente y finalmente se acerca a la de los átomos totalmente libres.
La distancia\(r_e\), que corresponde a la longitud del enlace a la energía mínima, aumenta con el número atómico hacia abajo en una columna de la tabla periódica a medida que los átomos se hacen más grandes. Disminuye a través de una fila horizontal de la tabla periódica a medida que aumenta la electronegatividad de los átomos y el radio atómico se vuelve más pequeño. Al igual que otras cosas, cuanto más fuerte sea el vínculo, más corto\(r_e\) será, porque un vínculo fuerte supera las fuerzas repulsivas entre los núcleos y así les permite acercarse más juntos. Para los enlaces entre dos átomos de carbono,\(r_e\) generalmente oscila entre aproximadamente\(1.20\) Å y\(1.55\) Å y, si se aplica la Figura 21-1 (o algo similar), no debemos esperar\(\ce{C-C}\) enlaces significativos a distancias internucleares mayores que\(2\) Å.
Es importante reconocer que la unión ocurre solo si los electrones están emparejados (es decir, tienen espines opuestos). La curva punteada superior de la Figura 21-1 muestra cómo cambia la energía a medida que dos átomos de hidrógeno se acercarán los espines paralelos entre sí. Que no hay enlace neto puede ser entendido por el principio Pauli (Sección 6-1), que nos dice que dos electrones no pueden estar en el mismo orbital si están desapareados.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


