23.13: Protección de Grupos Amino en Síntesis
- Page ID
- 72551
Hemos mencionado anteriormente que puede ser difícil asegurar una reacción química selectiva en un grupo funcional cuando otros grupos funcionales están presentes en la misma molécula. Los grupos amino son particularmente susceptibles a reacciones con una amplia variedad de reactivos, especialmente reactivos oxidantes, reactivos alquilantes y muchos compuestos carbonilo. Por lo tanto, si se desea evitar que el grupo amino sufra una reacción no deseada mientras se produce un cambio químico en otra parte de la molécula, debe protegerse adecuadamente. Hay más química documentada sobre métodos de protección de grupos amino que de cualquier otro grupo funcional. Esto se debe a que la síntesis peptídica se ha vuelto muy importante y, como veremos en el Capítulo 25, no es posible construir un péptido de estructura específica a partir de sus aminoácidos componentes a menos que los grupos amino puedan protegerse adecuadamente. Por lo tanto, ahora consideraremos los grupos protectores más útiles que están disponibles: cómo se introducen y cómo se eliminan.
Protonación
Debe quedar claro que la reactividad de las aminas normalmente implica algún proceso en el que se hace un enlace al par de electrones no compartidos sobre nitrógeno. Por lo tanto, cualquier reacción de una amina que reduzca la reactividad de este par de electrones debería reducir la reactividad del átomo de nitrógeno. La forma más sencilla de hacerlo sería convertir la amina en una sal de amonio con un ácido. La protonación equivale a la protección de la función amina:
\[\ce{RNH_2} + \ce{HX} \rightleftharpoons \ce{R} \overset{\oplus}{\ce{N}} \ce{H_3} \: \overset{\ominus}{\ce{X}}\]
Se conocen ejemplos en los que las aminas de hecho pueden protegerse de esta manera, pero a menos que la concentración de ácido sea muy alta, habrá una proporción significativa de base libre no protegida presente. Además, muchas reacciones deseables no son factibles en solución ácida.
Alquilación
Un procedimiento de protección relacionado es la alquilación (Ecuaciones 23-8 y 23-9), que es adecuada para aminas primarias y secundarias:
\[\ce{R'NH_2} + \ce{RX} \rightarrow \ce{R'NHR} + \ce{HX} \tag{23-8}\]
\[\ce{R'_2NH} + \ce{RX} \rightarrow \ce{R'_2NR} + \ce{HX} \tag{23-9}\]
A primera vista, es posible que no considere que tales reacciones logran protección porque hay un par de electrones sobre el nitrógeno en los productos. Sin embargo, se usa un agente alquilante adecuadamente voluminoso\(\ce{RX}\), la reactividad de la amina alquilada resultante se puede reducir considerablemente por un efecto estérico. El grupo más útil de este tipo es el grupo trifenilmetilo\(\ce{(C_6H_5)_3C}-\), que puede introducirse sobre el nitrógeno de la amina mediante la reacción del cloruro de trifenilmetilo (cloruro de “tritilo”) con la amina en presencia de una base adecuada para eliminar el\(\ce{HCl}\) que se forma:

El grupo trifenilmetilo se puede eliminar del nitrógeno de la amina en condiciones muy suaves, ya sea por hidrogenación catalítica o por hidrólisis en presencia de un ácido débil:

Acilación
Una manera útil de reducir la basicidad y nucleofilia de un nitrógeno amínico es convertirlo en una amida mediante tratamiento con un cloruro de ácido o anhídrido de ácido (Sección 18-7):
\[\begin{align} \ce{RNH_2} + \ce{CH_3COCl} &\rightarrow \ce{RNHCOCH_3} + \ce{HCl} \\ \ce{RNH_2} + \ce{(CH_3CO)_2O} &\rightarrow \ce{RNHCOCH_3} + \ce{CH_3CO_2H} \end{align}\]
La reactividad reducida se asocia con la estabilización producida por el grupo carbonilo unido debido a su capacidad para aceptar electrones del átomo de nitrógeno. Esto se puede ver claramente en las estructuras de enlace de valencia\(9a\) y\(9b\), que muestran deslocalización electrónica del par no compartido de la función amida:

La energía de estabilización (SE) de un simple agrupamiento amida es aproximadamente\(18 \: \text{kcal mol}^{-1}\), y si se produce una reacción en la que el nitrógeno amida actúa como un donador de pares de electrones, casi toda la deslocalización de electrones del grupo amida se pierde en el estado de transición:
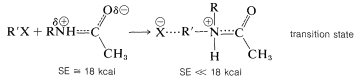
Esta pérdida de energía de estabilización en el estado de transición hace que una amida sea mucho menos nucleófila que una amina.
Los agentes acilantes más comunes son los cloruros de acilo y los anhidridos de ácido etanoico y ácido benzoico. La amina se puede recuperar de la amida mediante hidrólisis catalizada por ácido o base:

Otro grupo protector útil para aminas tiene la estructura\(\ce{R-O-CO}-\). Se diferencia de los grupos acilo comunes del tipo\(\ce{R-CO}-\) en que tiene la estructura alcoxi carbonilo en lugar de una estructura de alquilcarbonilo. Los ejemplos más utilizados son:

El grupo fenilmetoxicarbonil (bencioxicarbonil) se puede introducir por medio del cloruro de acilo correspondiente, que se prepara a partir de fenilmetanol (alcohol bencílico) y dicloruro de carbonilo:

El grupo terc - butoxicarbonilo no se puede introducir por medio del cloruro de acilo correspondiente debido a que\(\ce{(CH_3)_3COCOCl}\) es inestable. Uno de varios derivados alternativos es la azida,\(\ce{ROCON_3}\):

Aunque estos grupos protectores pueden parecer extraños, su valor radica en el hecho de que pueden eliminarse fácilmente por hidrólisis catalizada por ácido en condiciones muy suaves. La secuencia de etapas se muestra en la Ecuación 23-10 e implica la transferencia de protones al oxígeno carbonilo y la escisión del enlace carbono-oxígeno mediante un\(S_\text{N}1\) proceso (\(\ce{R} =\)terc - butilo) o\(S_\text{N}2\) proceso (\(\ce{R} =\)fenilmetilo). El producto de este paso es un ácido carbámico. Los ácidos de este tipo son inestables y eliminan fácilmente el dióxido de carbono, dejando solo la amina libre (ver también Sección 23-12E):

El grupo bencioxicarbonilo, pero no el grupo terc - butoxicarbonilo, se puede eliminar por hidrogenación catalítica. Nuevamente se forma un ácido carbámico, que pierde fácilmente\(\ce{CO_2}\):

Sulfonilación
Un grupo sulfonilo\(\ce{RSO_2}-\), como un grupo acilo,\(\ce{R-CO}-\) o\(\ce{RO-CO}-\), desactivará un nitrógeno unido. Por lo tanto, las aminas pueden protegerse por transformación en sulfonamidas con cloruros de sulfonilo (Sección 23-9C):
\[\ce{C_6H_5SO_2Cl} + \ce{RNH_2} \rightarrow \ce{C_6H_5SO_2NHR} + \ce{HCl}\]
Sin embargo, las sulfonamidas son mucho más difíciles de hidrolizar de nuevo a la amina que las carboxamidas. En la síntesis de péptidos (Sección 25-7C) los grupos protectores sulfonilo comúnmente utilizados son los grupos 4-metilbencenosulfonilo o 4-bromobencenosulfonilo. Estos grupos se pueden eliminar según sea necesario de la sulfonamida por reducción con sodio metálico en amoníaco líquido:

\(^6\)Esta abreviatura es aprobada por la Comisión de Nomenclatura Bioquímica de la IUPAC-UIB y es típica del tipo de “sopa de alfabeto” que está haciendo que la bioquímica sea casi completamente ininteligible sin un glosario de abreviaturas aprobadas (y no aprobadas) a la mano en todo momento. Haremos un uso mínimo de dichas designaciones. Recordarás que ya usamos\(\ce{Z}\) para otra cosa (Sección 19-7).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


