23.12: Síntesis de Aminas
- Page ID
- 72622
Principales tipos de síntesis
Aparentemente hay muchas formas diferentes en las que se pueden preparar las aminas. Sin embargo, una mirada cuidadosa a estos métodos revela que caen en tres grupos principales de reacciones. El primer grupo comienza con una amina simple, o con amoníaco, y construye la estructura de carbono mediante reacciones de alquilación o arilación sobre nitrógeno, como se discute en la Sección 23-9D:
\[\ce{RX} + \ce{NH_3} \rightarrow \ce{RNH_2} + \ce{HX}\]
El segundo grupo comienza con compuestos de la misma estructura carbono-nitrógeno que en la amina deseada pero con nitrógeno en un estado de oxidación superior. A continuación, la amina se obtiene a partir de estos compuestos por hidrogenación catalítica o reducción con hidruro metálico, como se describirá en la siguiente sección:
\[\ce{RNO_2} + 3 \ce{H_2} \overset{\ce{Pt}}{\longrightarrow} \ce{RNH_2} + 2 \ce{H_2O}\]
El tercer grupo de reacciones se basa en el hecho de que las amidas generalmente se pueden convertir en aminas, ya sea por reducción, hidrólisis o reordenamiento, de manera que cualquier síntesis viable de amidas suele ser también una síntesis de aminas:
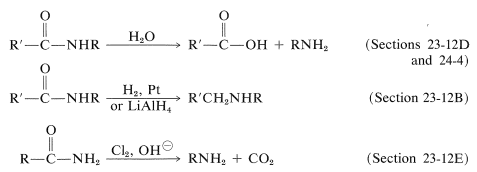
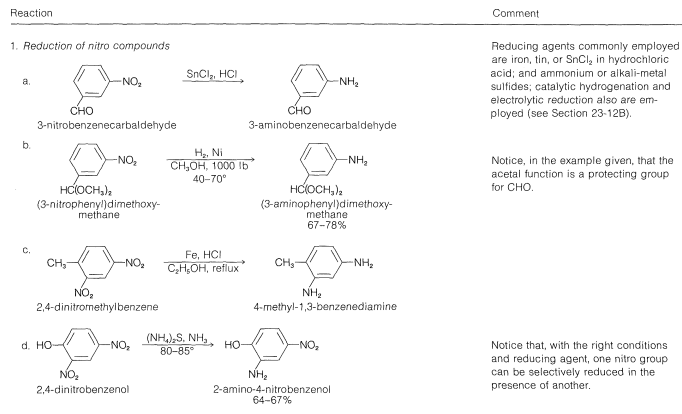
Estas y las reacciones relacionadas se discuten con mayor detalle en las siguientes secciones. Para su comodidad, en las Tablas 23-6 y 23-7 aparece un resumen tabular de los métodos para la síntesis de aminas.
Tabla 23-6: Ejemplos Prácticos de la Síntesis de Aminas
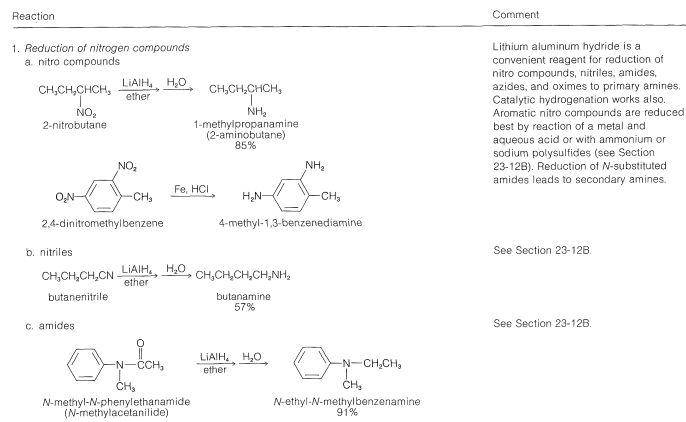
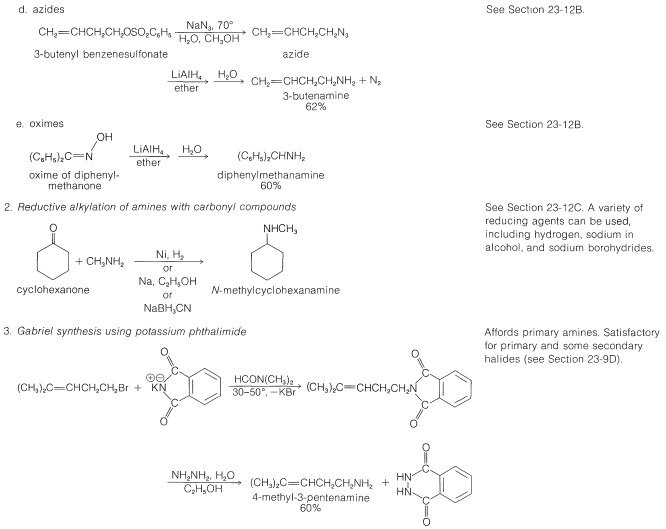
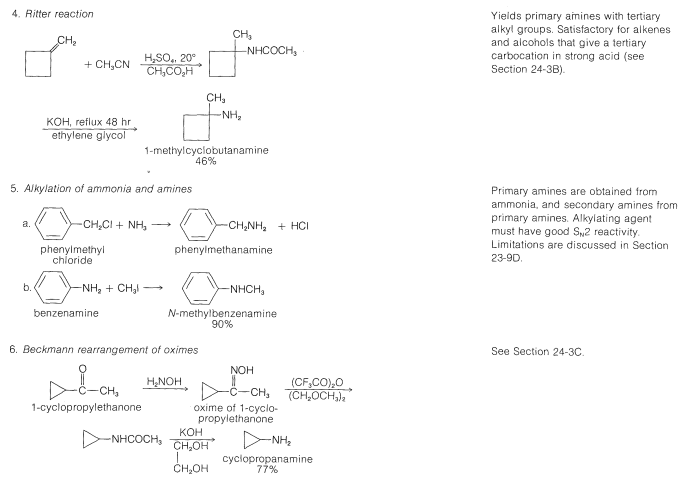
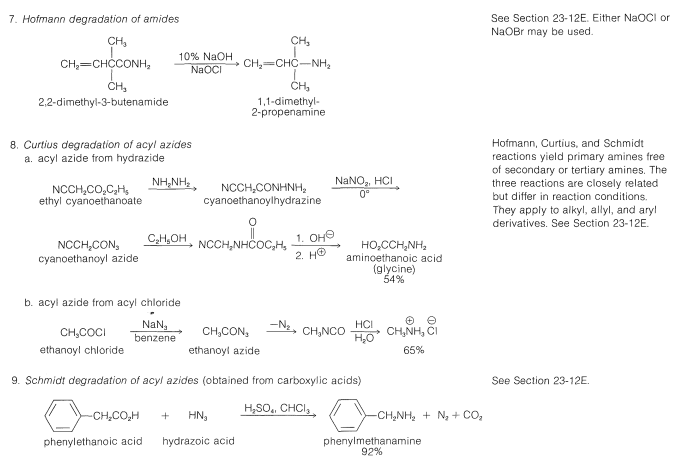
Tabla 23-7: Ejemplos Prácticos de la Síntesis de Aminas Aromáticas
.png)
Formación de Aminas por Reducción
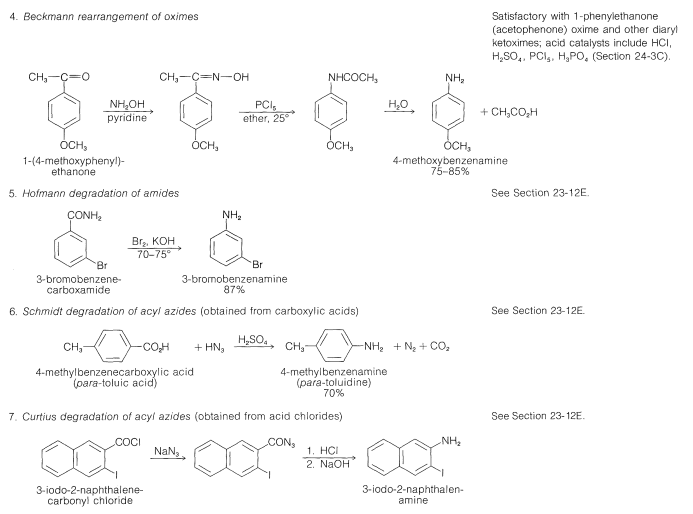
Se dispone de excelentes procedimientos para la preparación de aminas primarias, secundarias y terciarias mediante la reducción de una variedad de compuestos nitrogenados. Las aminas primarias se pueden obtener por hidrogenación o por reducción con hidruro de litio y aluminio de compuestos nitro, azidas, iminas, nitrilos o amidas no sustituidas [todo posible con\(\ce{H_2}\) sobre un catalizador metálico (\(\ce{Pt}\)o\(\ce{Ni}\)) o con\(\ce{LiAlH_4}\)]:

Se debe tener cierto cuidado en la reducción de los compuestos nitro porque tales reducciones pueden ser altamente exotérmicas. Por ejemplo, la reacción\(1 \: \text{mol}\)\(\left( 61 \: \text{g} \right)\) de nitrometano con hidrógeno para dar metanamina libera suficiente calor para aumentar la temperatura de una\(25\) - bomba de\(\text{lb}\) hierro\(100^\text{o}\):
Las aminas secundarias y terciarias, particularmente aquellas con diferentes\(\ce{R}\) grupos, se preparan fácilmente por reducción con hidruro de litio y aluminio de amidas sustituidas (Sección 18-7C).
Aminas por Alquilación Reductora de Aldehídos y Cetonas
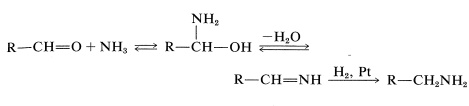
Una síntesis útil de aminas primarias y secundarias que se relaciona con las reducciones que se acaban de describir utiliza la reacción de un aldehído o una cetona con amoníaco o una amina primaria en presencia de hidrógeno y un catalizador metálico:
\[\begin{align} \ce{RCHO} + \ce{NH_3} + \ce{H_2} &\overset{\ce{Pt}}{\longrightarrow} \ce{RCH_2NH_2} + \ce{H_2O} \\ \ce{R_2C=O} + \ce{CH_3NH_2} + \ce{H_2} &\overset{\ce{Pd}}{\longrightarrow} \ce{R_2CHNHCH_3} + \ce{H_2O} \end{align}\]
Es razonable suponer que el compuesto carbonilo forma primero el derivado de imina por medio del aminoalcohol (ver Sección 16-4C), y este derivado se hidrogena bajo las condiciones de reacción:
Se pueden usar otros agentes reductores, y la sal de borohidruro\(\ce{Na}^\oplus \: ^\ominus \ce{BH_3(CN)}\) es conveniente de usar en lugar\(\ce{H_2}\) de un catalizador metálico.
En un sentido formal, el compuesto carbonilo se reduce en esta reacción mientras que la amina se alquila, de ahí el término alquilación reductora o aminación reductora.
Aminas de Amidas por Hidrólisis o Reducción
Hay una serie de formas en las que una amida puede transformarse en una amina. Dos de estas formas ya se han mencionado e implican hidrólisis o reducción:
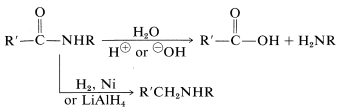
Como medio de síntesis de aminas, ambos métodos dependen de la disponibilidad o la facilidad de síntesis de la amida correspondiente.
Aminas a partir de amidas por la degradación de Hofmann
Una reacción interesante y general para la preparación de aminas primarias es la degradación de Hofmann, en la que una amida no sustituida se convierte en una amina por bromo (o cloro) en solución de hidróxido de sodio:
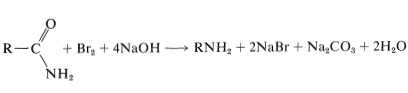
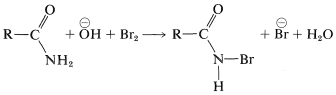
El mecanismo de esta reacción inusual implica primero la bromación catalizada por bases de la amida sobre nitrógeno para dar un intermedio de\(\ce{N}\) -bromoamida:
Se sigue una eliminación inducida por bases\(\ce{HBr}\) del nitrógeno para formar un intermedio “nitreno”, que es análogo a la formación de un carbeno (Sección 14-7B):
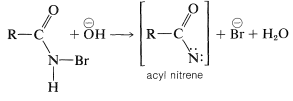
Como cabría esperar de la estructura de un acil nitreno (solo seis electrones en la capa de valencia del nitrógeno), es altamente inestable pero puede estabilizarse haciendo que el grupo sustituyente se mueva como\(\ce{R}^\ominus\) de carbono a nitrógeno:\(^5\)
El reordenamiento es estereoespecífico y se retiene la configuración en el carbono migratorio (ver Sección 21-10F). El producto de reordenamiento se llama isocianato y es un análogo de nitrógeno de una cetena\(\left( \ce{R_2C=C=O} \right)\); al igual que las cetenas, los isocianatos añaden fácilmente agua. Los productos son ácidos carbámicos, que no son muy estables, especialmente en solución básica, y pierden fácilmente dióxido de carbono para dar la amina:
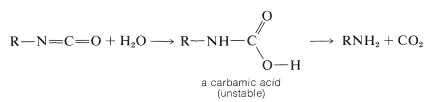
Un ejemplo práctico de esta reacción se da en la Tabla 23-6 junto con ejemplos de reacciones relacionadas conocidas como los reordenamientos de Curtius y Schmidt. Los dos últimos probablemente también implican el reordenamiento de un acil-nitreno, esta vez formado por la descomposición de una acil-azida:
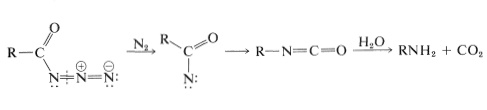
\(^5\)Existen varias analogías para este tipo de reordenamiento que involucran carbono deficiente en electrones (Secciones 8-9B y 15-5E) y oxígeno (Sección 16-9E).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


