24.3: Síntesis de amidas
- Page ID
- 73253
De Acidos Carboxílicos
La formación de amidas a partir de derivados de ácido carboxílico ya se ha discutido con cierto detalle (Sección 23-9A):
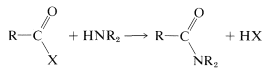 \(\tag{24-1}\)
\(\tag{24-1}\)
La facilidad de formación de amidas por la reacción de la Ecuación 24-1 depende mucho de la naturaleza del grupo de salida\(\ce{X}\). Las características de un buen grupo de salida se discutieron en las Secciones 8-7C y 8-7D en relación con\(S_\text{N}\) las reacciones, y consideraciones similares se aplican aquí. Alguna idea del rango de derivados ácidos utilizados en la síntesis de amidas se puede obtener del Cuadro 24-1, que enumera diversos\(\ce{RCOX}\) compuestos y los\(K_a\) valores de p de\(\ce{HX}\). Como regla general razonable, cuanto más fuerte\(\ce{HX}\) es como ácido, mejor\(\ce{X}\) es como grupo de salida.
Tabla 24-1: Derivados y reactividad de ácidos carboxílicos comúnmente utilizados en la formación de amidas
\[\ce{RCOX} + \ce{H_2NR'} \rightarrow \ce{RCONHR'} + \ce{HX}\]
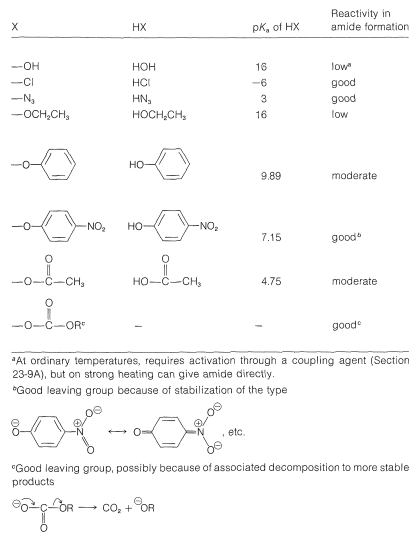
Las amidas generalmente se forman a partir de cloruros de ácido, azidas ácidas, anhidridos de ácido y ésteres. No es práctico prepararlos directamente a partir de una amina y un ácido carboxílico sin un fuerte calentamiento o a menos que la reacción se acople a una segunda reacción que “active” el ácido. Observe que los ésteres de fenoles son más reactivos hacia las aminas que los ésteres de alcoholes porque los fenoles son ácidos más fuertes que los alcoholes.
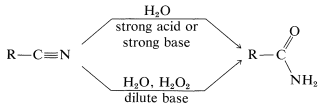
De Nitrilos
La hidrólisis de nitrilos es un método satisfactorio para la preparación de amidas no sustituidas y es particularmente conveniente cuando la hidrólisis es inducida en condiciones ligeramente básicas por peróxido de hidrógeno:
Para la preparación de amidas del tipo\(\ce{R_3CNHCOR}\), que tienen un grupo alquilo terciario unido a nitrógeno, es altamente ventajosa la reacción de Ritter de un alcohol o alqueno con un nitrilo o cianuro de hidrógeno. Esta reacción implica la formación de un carbocatión por acción de ácido sulfúrico fuerte sobre un alqueno o un alcohol (Ecuación 24-2), combinación del carbocatión con los electrones no compartidos sobre nitrógeno de\(\ce{RCN}\) (Ecuación 24-3), y luego adición de agua (Ecuación 24-4). Utilizamos aquí la preparación de una\(\ce{N}\) - terc- butilalcanamida como ejemplo;\(\ce{RC \equiv N}\) puede ser un cianuro de alquilo como el etanitrilo o el propio cianuro de hidrógeno:
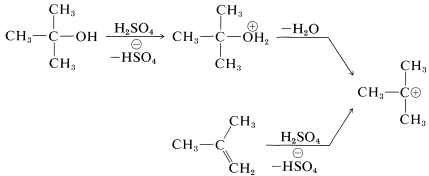 \(\tag{24-2}\)
\(\tag{24-2}\)
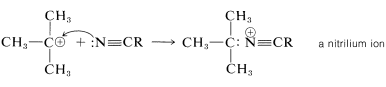 \(\tag{24-3}\)
\(\tag{24-3}\)
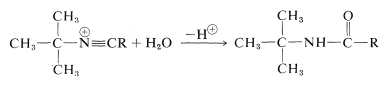 \(\tag{24-4}\)
\(\tag{24-4}\)
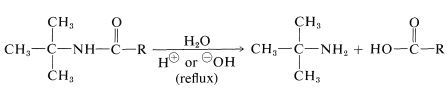
Esta reacción también es útil para la preparación de aminas primarias por hidrólisis de la amida. Es uno de los relativamente pocos métodos prácticos para sintetizar aminas con un grupo alquilo terciario en el nitrógeno:
El reordenamiento de Beckmann de las oximas
Tal vez recuerde que las cetonas reaccionan con\(\ce{RNH_2}\) compuestos para dar productos con doble enlace al nitrógeno,\(\ce{-C=NR}\) (Sección 16-4C). Cuando el\(\ce{RNH_2}\) compuesto es azanol (hidroxilamina)\(\ce{HO-NH_2}\), el producto se llama cetoxima, u oxima:
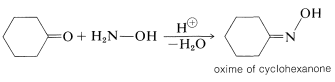
Las oximas se reordenan cuando se calientan con un ácido fuerte, y esta reacción proporciona una síntesis útil de amidas:
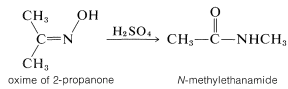
Esta intrigante reacción se conoce como el reordenamiento de Beckmann. Ha sido objeto de una serie de estudios mecanicistas que han demostrado que el ácido o haluro de ácido (\(\ce{PCl_3}\),\(\ce{C_6H_5SO_2Cl}\)) convierte el grupo hidroxilo sobre el nitrógeno en un mejor grupo lápida formando\(\ce{-OH_2^+}\) o éster intermedios:
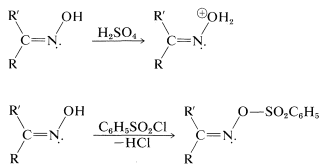
A partir de entonces, se produce un reordenamiento parecido a las reacciones de los carbocationes (Secciones 8-9B y 15-5E). Cuando se produce la escisión del\(\ce{N-O}\) enlace, el átomo de nitrógeno quedaría con sólo seis electrones de valencia. Sin embargo, a medida que el enlace se rompe, un sustituyente\(\ce{R}\) en el carbono vecino se mueve con su par de electrones de enlace al nitrógeno positivo en desarrollo (Ecuación 24-5):
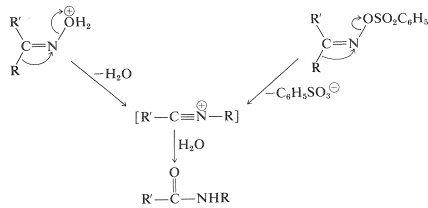 \(\tag{24-5}\)
\(\tag{24-5}\)
Las oximas con\(\ce{R}\) y\(\ce{R'}\) como diferentes grupos existen como\(E\) e\(Z\) isómeros (Sección 19-7) y notarás en la Ecuación 24-5 que el grupo que migra es el que es trans al grupo de salida. Hasta cierto punto el reordenamiento de Beckmann es una\(S_\text{N}2\) reacción interna con inversión en el nitrógeno. La sección 21-10F da un tratamiento teórico de este tipo de reacciones. El producto de reordenamiento es un ion nitrilio, como en la reacción de Ritter (Sección 24-3B), que agrega agua para formar la amida.
La síntesis de aza-2-cicloheptanona (\(\varepsilon\)-caprolactama) por el reordenamiento Beckmann de la oxima de ciclohexanona es de importancia comercial porque la lactama es un intermedio en la síntesis de un tipo de nylon (una poliamida llamada “nylon-6"\(^2\)):
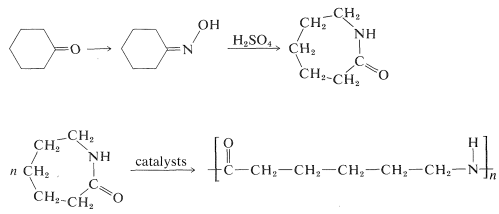
\(^2\)El número 6 especifica el número de carbonos en cada unidad de monómero que comprende la estructura de poliamida. Por este código, nylon-6,6 es\(\ce{(-NH(CH_2)_6NHCO(CH_2)_4CO-)}_n\).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


