25.2: Propiedades Ácido-Base de\(\alpha\)-Amino Acids
- Page ID
- 72633
El comportamiento de la glicina es razonablemente típico del de los aminoácidos más simples. Debido a que la glicina no es ni un ácido fuerte ni una base fuerte, esperaremos que una solución de glicina en agua contenga cuatro especies en rápido equilibrio. Se espera que las proporciones de estas especies cambien con el pH, siendo el ácido conjugado catiónico la forma predominante a pH bajo y favoreciendo la base conjugada aniónica a pH alto:
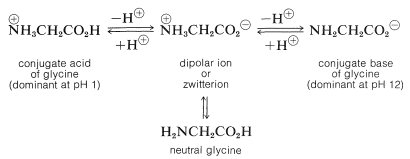
Las mediciones espectroscópicas muestran que el equilibrio entre glicina neutra y el ion dipolar favorece al ión dipolar en al menos 100 a 1. Esto es de esperar porque el\(\ce{H_3} \overset{\oplus}{\ce{N}}-\) grupo del ion dipolar estabilizará el\(\ce{-CO_2^-}\) extremo mientras que el\(\ce{-CO_2^-}\) grupo estabilizará el\(\ce{H_3} \overset{\oplus}{\ce{N}}-\) extremo.
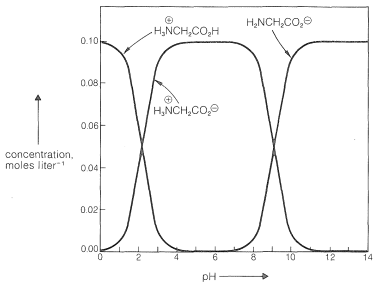
La constante de ionización ácida de\(\ce{H_3} \overset{\oplus}{\ce{N}} \ce{CH_2CO_2H}\) es\(4.5 \times 10^{-3}\) (p\(K_a\)\(= 2.34\), Ecuación 25-1), que es aproximadamente 25 veces mayor que\(K_a\) para el ácido etanoico (Sección 18-2). Esto se espera debido al efecto electrostático atrayente de electrones del\(\ce{H_3} \overset{\oplus}{\ce{N}}-\) grupo. La ionización del\(\ce{H_3} \overset{\oplus}{\ce{N}}-\) grupo del ion dipolar (\(K_a = 2.0 \times 10^{-10}\); p\(K_a = 9.60\); Ecuación 25-2) se ve afectada de manera opuesta por el efecto electrostático del\(\ce{-CO_2^-}\) grupo y es 10 veces menor que la del ión etanamonio (Sección 23-7B). La manera en que las concentraciones de las especies de glicina cargadas cambian con el pH se muestra en la Figura 25-1. Observe que, entre pH 3 y pH 8, casi toda la glicina está en forma del ión dipolar. El pH en el centro de este rango, donde la concentración de\(\ce{H_3} \overset{\oplus}{\ce{N}} \ce{CH_2CO_2H}\) es igual a la concentración de\(\ce{H_2NCH_2CO_2^-}\), se denomina punto isoeléctrico, p I, y generalmente corresponde al pH al que el aminoácido tiene solubilidad mínima en agua. Los puntos isoeléctricos para los aminoácidos se muestran en la Tabla 25-1. Los puntos isoeléctricos son el promedio de los\(K_a\) valores de p para la disociación de la monocación y las formas de iones dipolares del aminoácido. Para glicina, p. I\(= \left( 2.34 + 9.60 \right) /2\).
\[\text{p} K_a = \text{pH} + \text{log}_{10} \frac{\left[ \ce{H_3} \overset{\oplus}{\ce{N}} \ce{CH_2CO_2H} \right]}{\left[ \ce{H_3} \overset{\oplus}{\ce{N}} \ce{CH_2CO_2^-} \right]} = 2.34 \tag{25-1}\]
\[\text{p} K'_a = \text{pH} + \text{log}_{10} \frac{\left[ \ce{H_3} \overset{\oplus}{\ce{N}} \ce{CH_2CO_2^-} \right]}{\left[ \ce{H_3NCH_2CO_2^-} \right]} = 9.60 \tag{25-2}\]
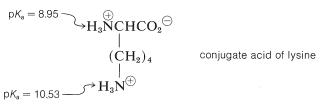
El comportamiento del pH de los aminoácidos con grupos funcionales ácidos o básicos unidos a las cadenas laterales es más complicado que el de los aminoácidos simples. Por ejemplo, hay tres disociaciones ácidas que comienzan con el ácido diconjugado de lisina:
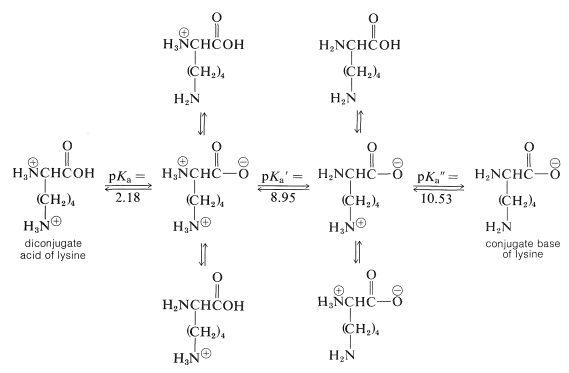
\(K_a\)Los valores de p para las funciones de cadena lateral de los aminoácidos ácidos y básicos se dan en la Tabla 25-1.
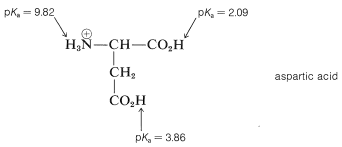
Ya mencionamos cómo el\(\ce{H_3} \overset{\oplus}{\ce{N}}-\) grupo del ácido conjugado de glicina potencia la fuerza ácida del grupo carboxilo en comparación con el ácido etanoico y cómo el\(\ce{-CO_2^-}\) grupo reduce la acidez del\(\ce{H_3} \overset{\oplus}{\ce{N}}-\) grupo del ion dipolar en relación con el ion etanamonio. Estos efectos serán menores cuanto más lejos esté el grupo cargado del grupo ionizable. Como resultado, se podría predecir que los grupos carboxilo del ácido aspártico tendrían diferentes\(K_a\) valores de p, y de hecho esto es así:
De manera similar, el grupo amonio de cadena lateral de la lisina es menos ácido que el del grupo amonio cercano al grupo carboxilo:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


