29.5: Correlación de las propiedades del polímero con la estructura
- Page ID
- 73157
Las propiedades de muchos de los polímeros termoplásticos y elásticos comercialmente importantes se pueden entender en términos de sus estructuras químicas utilizando los conceptos desarrollados en la sección anterior. Así, los polímeros lineales simples, polieteno\(\ce{-(CH_2CH_2)}_n-\), polimetanal\(\ce{-(CH_2-O)}_n-\) y politetrafluoroeteno\(\ce{-(CF_2-CF_2)}_n-\), con cadenas regulares y barreras bajas para la rotación alrededor de los enlaces en la cadena tienden a ser en gran parte cristalinos con puntos de fusión bastante altos y bajas temperaturas vítreas (ver Tabla 29-1). La situación con policloroeteno (cloruro de polivinilo), polifluoroeteno (fluoruro de polivinilo) y polietenilbenceno (poliestireno) como se suele preparar es bastante diferente. Estos polímeros son mucho menos cristalinos y, sin embargo, tienen temperaturas vítreas bastante altas, lo que sugiere que existe una fuerza de atracción considerable entre las cadenas. El bajo grado de cristalinidad de estos polímeros es el resultado de que tienen un bajo grado de regularidad de la configuración estereoquímica de los carbonos quirales en la cadena. El descubrimiento de G. Natta en 1954 de que las configuraciones estereoquímicas de los centros quirales en cadenas poliméricas podrían ser cruciales para determinar sus propiedades físicas ha tenido un profundo impacto tanto en los aspectos prácticos como teóricos de la química de polímeros. El trabajo de Natta se realizó principalmente con polipropeno y esta sustancia proporciona un excelente ejemplo de la importancia de las configuraciones estereoquímicas.
Cuadro 29-1: Polímeros sintéticos termoplásticos y elásticos representativos y sus usos\(^a\)
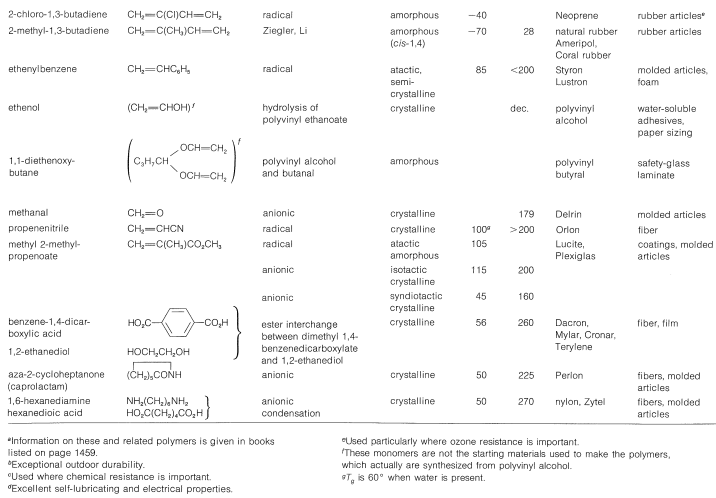
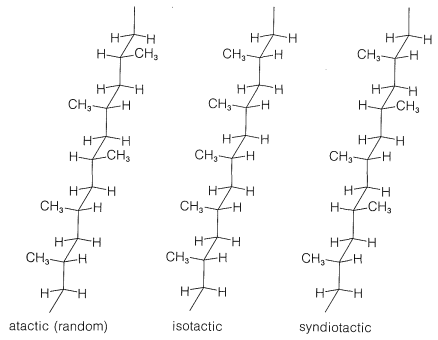
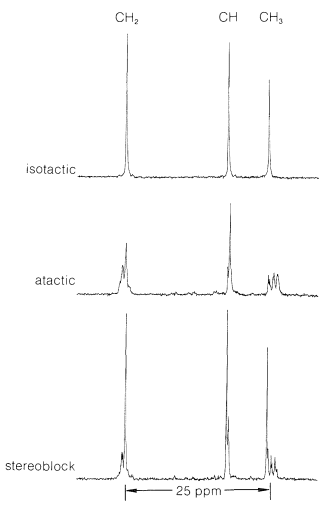
Existen diferencias notables en las propiedades físicas entre las formas atáctica e isotáctica. El material atáctico es blando, elástico, algo pegajoso y bastante soluble en solventes como 1,1,2,2-tetracloroetano. El polipropeno isotáctico es un polímero cristalino duro, claro y fuerte que se funde en\(175^\text{o}\). Es prácticamente insoluble en todos los disolventes orgánicos a temperatura ambiente, pero se disolverá en la medida de unos pocos por ciento en 1,1,2,2-tetracloroetano caliente. Que la diferencia entre los polímeros atácticos e isotácticos irises de las diferencias en las configuraciones de los grupos metilo en las cadenas se muestra de manera llamativa mediante espectros de\(\ce{^{13}C}\) RMN (Figura 29-9). Las diferencias en estos espectros resultan de diferencias en las interacciones entre los grupos metilo para las diferentes configuraciones, de la misma manera que le hemos mostrado anteriormente para grupos metilo axiales y ecuatoriales en anillos de ciclohexano (Sección 12-3D).
¿Por qué el polipropeno debería fundirse tanto más alto que el polietileno (\(175^\text{o}\)vs.\(110^\text{o}\))? La respuesta radica en las diferencias entre la forma en que cristalizan los polímeros. Los cristalitos de polietileno tienen cadenas extendidas en zig-zag que tienen barreras muy bajas para la rotación alrededor de los\(\ce{C-C}\) enlaces. Debido a las interferencias entre los grupos metilo, el polipropeno no cristaliza en cadenas extendidas en zig-zag sino que forma una hélice, algo así como la\(\alpha\) hélice (Sección 25-8A), con los carbonos de la cadena en el interior y los carbonos metílicos en el exterior. Estas bobinas son más rígidas que las\(\ce{CH_2}\) cadenas extendidas en polieteno y tienen\(\ce{H} \cdots \ce{H}\) interacciones intercadenas estabilizantes para que se requiera una temperatura más alta para fundir. El polipropeno puede ser estirado en frío para formar fibras que se asemejan a las fibras de nylon aunque, como cabría esperar, estas fibras no coinciden con el punto de\(270^\text{o}\) fusión del nylon y, debido a su carácter hidrocarbonado, son mucho más difíciles de teñir.
Aunque tanto el polietileno lineal como el polipropeno isotáctico son polímeros cristalinos, los copolímeros de eteno-propeno preparados con la ayuda de catalizadores Ziegler son excelentes elastómeros. Al parecer, una introducción más o menos aleatoria de grupos metilo a lo largo de una cadena de polietileno reduce la cristalinidad de manera suficientemente drástica como para conducir a un polímero amorfo. El copolímero de eteno-propeno es un elastómero económico, pero al no tener dobles enlaces, no es capaz de vulcanización. La polimerización de eteno y propeno en presencia de una pequeña cantidad de diciclopentadieno o 1,4-hexadieno da un heteropolímero insaturado, que puede vulcanizarse con azufre de la manera habitual.

La razón de usar estos dienos particulares es que solo el doble enlace tensado del diciclopentadieno y el doble enlace terminal del 1,4-hexadieno experimentan polimerización con catalizadores Ziegler. En consecuencia, las cadenas poliméricas contienen un doble enlace por cada molécula de diciclopentadieno o 1,4-hexadieno que se incorpora. Estos dobles enlaces posteriormente se pueden convertir en reticulaciones por vulcanización con azufre (Secciones 13-4 y 29-3).
El policloroeteno (cloruro de polivinilo), como se suele preparar, es atáctico y no muy cristalino. Es relativamente quebradizo y vítreo. Las propiedades del cloruro de polivinilo pueden mejorarse por copolimerización, como con etenilo etanoato (acetato de vinilo), que produce un polímero más blando (“Vinylite”) con mejores propiedades de moldeo. El cloruro de polivinilo también se puede plastificar mezclándolo con sustancias de baja volatilidad como tris- (2-metilfenil) fosfato (tricrelil fosfato) y dibutilbenceno-1,2-dicarboxilato (dibutil ftalato) que, al disolverse en el polímero, tienden a descomponer su estructura vítrea. El cloruro de polivinilo plastificado es razonablemente flexible y se usa ampliamente como aislamiento eléctrico, láminas de plástico, etc.
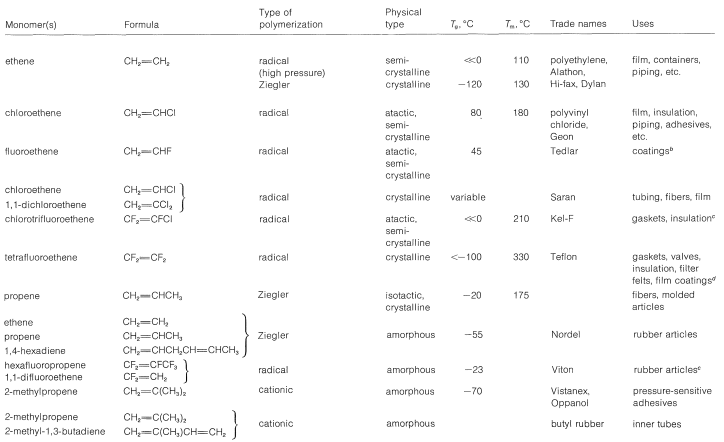
El Cuadro 29-1 contiene información sobre una serie de polímeros importantes representativos y sus usos. Ya se han dado algunos datos similares sobre otros polímeros (Sección 13-4 y Cuadro 10-4). El importante uso de polímeros modificados como resinas de intercambio iónico se discute en la Sección 25-4C.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


