30.5: Biosíntesis
- Page ID
- 72778
Ácidos grasos
La idea de que el ácido etanoico (ácido acético) es un posible material de partida común para la biosíntesis de muchos compuestos orgánicos fue propuesta por primera vez por Collie (1893) por motivos puramente estructurales. Reconoció una conexión estructural entre una cadena lineal de\(\ce{CH_3CO}\) unidades recurrentes (una cadena de policetometileno\(\ce{CH_3COCH_2COCH_2COCH_2CO}-\)) y ciertos productos naturales cíclicos. En el ejemplo que se da a continuación, el ácido orsellínico se representa como si se derivara de una cadena de cuatro\(\ce{CH_3CO}\) unidades mediante una reacción de condensación-ciclación:
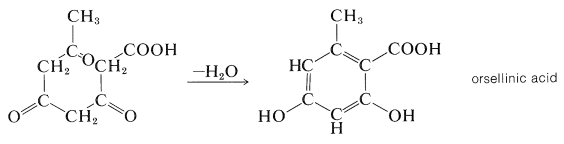
La verificación experimental de la hipótesis de Collie llegó muchos años después cuando el hidrógeno isotópico y el carbono (\(\ce{^2H}\)\(\ce{^3H}\),\(\ce{^{13}C}\),, y\(\ce{^{14}C}\)) estuvieron disponibles. Los estudios de trazadores mostraron que los ácidos grasos de cadena larga son elaborados por plantas y animales a partir de\(\ce{CH_3CO}\) unidades uniendo sucesivamente el grupo carbonilo de uno al grupo metilo de otro (K. Bloch y F. Lynen, Premio Nobel, 1964). Si el ácido etanoico suministrado al organismo está marcado en el grupo carboxilo con\(\ce{^{14}C} \: \left( \overset{*}{\ce{C}} \right)\), el ácido graso tiene el marcador en carbonos alternos:
\[\ce{CH_3} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{O_2H}\]
Sin embargo, si el carbono del grupo metilo está marcado, el producto sale etiquetado en el otro conjunto de carbonos alternos:
\[\overset{*}{\ce{C}} \ce{H_3CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CH_2} \overset{*}{\ce{C}} \ce{H_2CO_2H}\]
El ácido etanoico se activa para biosíntesis por combinación con el tiol, coenzima A (\ textbf {CoA}\ ce {SH}\), Figura 18-7) para dar el tioéster, etanoil (acetil) coenzima A\(\left( \ce{CH_3COS} \textbf{CoA} \right)\). Recordarás que la degradación metabólica de las grasas también involucra esta coenzima (\ (\ alfa\) Carbones de Derivados de Acidos Carboxílicos” href=” /Librerías/Química orgánica/libro:_básico_principios_de_químicaorgánica _ (Roberts_and_caserio) /18:_carboxilic_acids_and_su_derivativos/18.09:_reacciones_at_El/ (/alpha/) _carbons_of_carboxilic_acid_derivados #18 -8f_biológico_claisen_condensaciones_y_aldol_adiciones. _Fatty_Acid_Metabolismo">Sección 18-8F) y es tentador suponer que la biosíntesis de ácidos grasos es simplemente la inversa del metabolismo de los ácidos grasos a\(\ce{CH_3COS} \textbf{CoA}\). Sin embargo, este no es el caso del todo. De hecho, es una observación general en bioquímica que los metabolitos primarios se sintetizan por diferentes vías de aquellas por las que se metabolizan (por ejemplo, comparar las vías del carbono en la fotosíntesis y el metabolismo de los carbohidratos en las Secciones 20-9 y 20-10).
A continuación se presenta una breve descripción de los principales eventos en la biosíntesis de ácidos grasos, y todos estos pasos deben entenderse bajo el control de las enzimas apropiadas y sus coenzimas aunque aquí se omiten.
El\(\ce{CH_3CO}\) grupo de etanoil coenzima A se transfiere primero a una proteína que tiene un\(\left( \ce{SH} \right)\) grupo tiol libre para hacer otro tioéster, representado aquí como\(\ce{CH_3COS}-\textbf{ACP}\), donde ACP significa A cil-C arrier- P roteína. La cadena de carbono en crecimiento permanece unida a esta proteína a lo largo de la síntesis:
\[\ce{CH_3COS} \textbf{CoA} + \ce{HS}-\textbf{ACP} \rightarrow \ce{CH_3COS}-\textbf{ACP} + \textbf{CoA} \ce{SH}\]
La carboxilación de\(\ce{CH_3COS}-\textbf{ACP}\) produce un tioéster de propanodioílo\(6\), que luego experimenta una condensación de Claisen con un segundo mol de\(\ce{CH_3COS}-\textbf{ACP}\) acompañado de descarboxilación para producir un tioéster de 3-oxobutanoílo,\(7\):
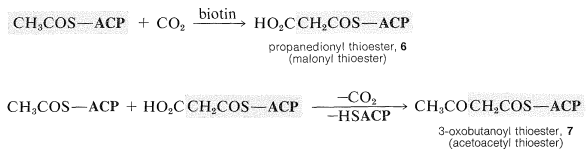
La reducción del grupo cetona del tioéster (por\(\ce{NADPH}\)) conduce a un éster tiol de un ácido carboxílico de cuatro carbonos. Las condensaciones repetitivas con tioéster\(6\) seguidas de reducción eventualmente conducen a ácidos grasos. Cada repetición aumenta la longitud de la cadena en dos carbonos:
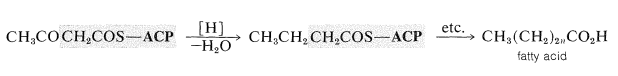
El esquema anterior es representativo de la biosíntesis de ácidos grasos en plantas, animales y bacterias. La principal diferencia es que los ácidos grasos vegetales y bacterianos suelen contener más dobles enlaces (o incluso triples enlaces) que los ácidos grasos animales.
Biosíntesis de Anillos Aromáticos
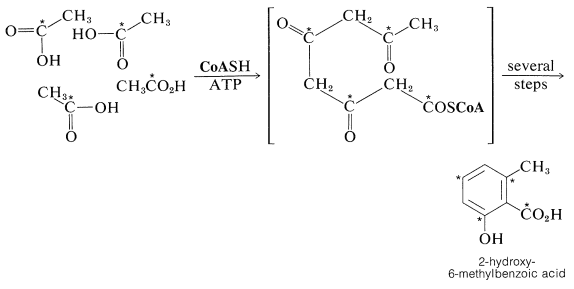
La hipótesis de Collie de que los compuestos aromáticos se elaboran biológicamente a partir del ácido etanoico fue ampliamente expandida por A. J. Birch para incluir un número extraordinario de compuestos diversos. El nombre genérico “acetogenina” ha sido sugerido como una clasificación conveniente para los productos naturales derivados del etanoato (acetato), pero también se usa el nombre “policétidos”. Los compuestos aromáticos de origen natural y las quinonas se elaboran en gran medida de esta manera. Un ejemplo es el ácido 2-hidroxi-6-metilbenzoico formado como metabolito del molde Penicillium urticae; usando ácido etanoico\(\ce{^{14}C}\) marcado con carboxilo, se ha demostrado que el marcador está en las posiciones que se indican a continuación:
Biosíntesis de terpenos
La biosíntesis de terpenos sigue claramente un curso algo diferente al de los ácidos grasos en que se forman compuestos de cadena ramificada. Una forma en que esto puede ocurrir es que la 2-oxobutanoil coenzima A se someta a una adición aldólica en el grupo ceto-carbonilo con la etanoil coenzima A para dar el derivado del ácido 3-metil-3-hidroxipentanoico,\(8\):
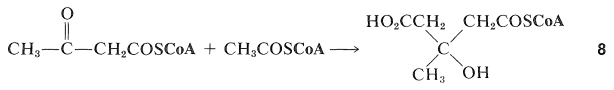
El siguiente paso es la reducción de uno de los grupos carboxilo de\(8\) para dar ácido mevalónico:
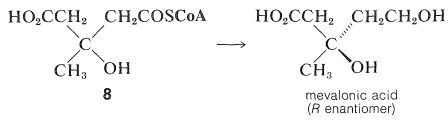
Esta sustancia ha sido demostrada por estudios de trazadores como un precursor eficiente de terpenos y esteroides. El ácido mevalónico tiene seis átomos de carbono, mientras que la unidad de isopreno tiene sólo cinco. Por lo tanto, si el ácido mevalónico es el precursor de las unidades de isopreno, debe perder un átomo de carbono en alguna etapa. La síntesis de ácido mevalónico marcado en el grupo carboxilo con\(\ce{^{14}C}\), y el uso de este material como material de partida para la producción de colesterol, da colesterol sin marcar. Por lo tanto, el carbono carboxilo es el que se pierde:
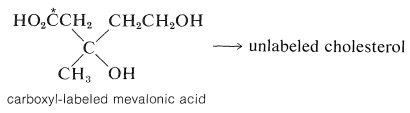
Se ha demostrado que la formación de la “unidad biológica de isopreno” a partir del ácido mevalónico procede por fosforilación escalonada de ambos grupos alcohol, luego eliminación y descarboxilación para producir pirofosfato de 3-metil-3-butenilo,\(9\) (a menudo llamado pirofosfato de\(\Delta^3\) isopentenilo):
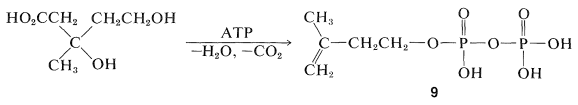
Se ha sugerido que el acoplamiento de las unidades de cinco carbonos\(9\),, para dar compuestos isoprenoides, proceda por los siguientes pasos. En primer lugar, la isomerización del doble enlace se efectúa mediante una enzima\(\left( \ce{E} \right)\) que porta un\(\ce{SH}\) grupo:
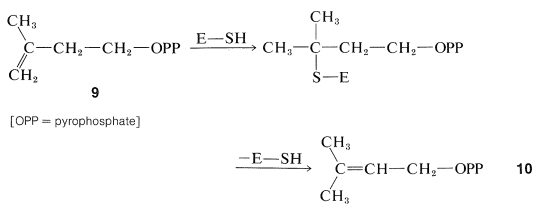
El éster,\(10\), luego se conecta al doble enlace de una molécula de\(9\), probablemente en un tipo de polimerización de carbocatión inducido por enzimas (Sección 10-8B):
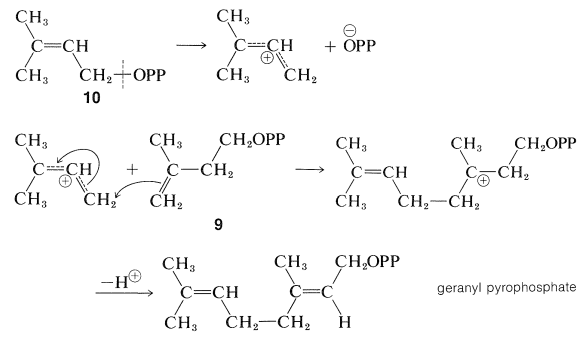
El producto de la combinación de dos unidades del pirofosfato\(9\), a través de esta secuencia es pirofosfato de geranilo si, como se muestra, el protón se pierde para dar un doble enlace trans. La formación de un doble enlace cis daría pirofosfato de nerilo (Sección 30-3B).
La continuación de la adición cabeza-cola de unidades de cinco carbonos al pirofosfato de geranilo (o nerilo) puede proceder de la misma manera al pirofosfato de farnesilo y así a la gutapercha (o caucho natural). En alguna etapa, se debe involucrar un nuevo proceso porque, aunque muchos compuestos isoprenoides son polímeros de isopreno tipo cabeza a cola, otros, como escualeno, licopeno y\(\beta\) - y\(\gamma\) -caroteno (Cuadro 30-1), se forman de manera diferente. El escualeno, por ejemplo, tiene una estructura formada a partir del acoplamiento reductor cabeza a cabeza de dos pirofosfatos de farnesilo:
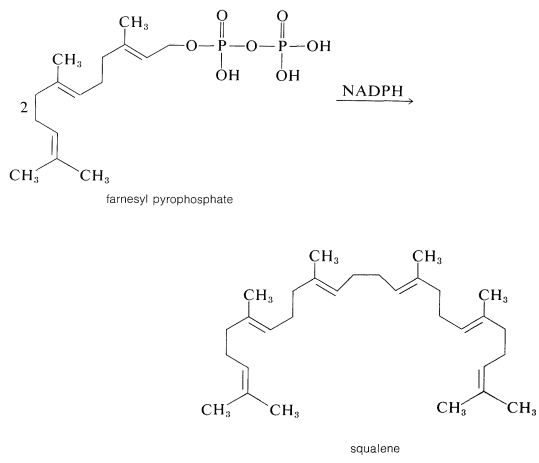
Dado que el escualeno se puede producir a partir de pirofosfato de farnesilo con\(\ce{NADPH}\) un sistema enzimático adecuado, las características generales del esquema anterior para la biosíntesis de terpenos están bien respaldadas por el experimento.
En resumen, la secuencia de etanoato a escualeno se ha rastreado como
\[\text{ethanoyl coenzyme A} \rightarrow \text{mevalonic acid} \rightarrow \text{isopentenyl pyrophosphate} \rightarrow \text{farnesyl pyrophosphate} \rightarrow \text{squalene}\]
Biosíntesis de Colesterol
Los experimentos de marcaje isotópico muestran que el colesterol se deriva del etanoato por medio de escualeno y lanosterol. La evidencia de esto es que el tejido hepático homogeneizado es capaz de convertir escualeno marcado en lanosterol marcado y de ahí en colesterol marcado. La conversión de escualeno a lanosterol es particularmente interesante porque, aunque el escualeno es divisible en unidades de isopreno, el lanosterol no lo es, requiriéndose un metilo en\(\ce{C_8}\) y no\(\ce{C_{13}}\):
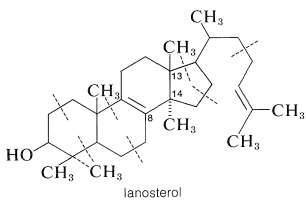
En consecuencia, se debe requerir algún tipo de reordenamiento para pasar del escualeno al lanosterol. La naturaleza de este reordenamiento se vuelve más clara si escribimos la fórmula del escualeno para tomar la forma del lanosterol:
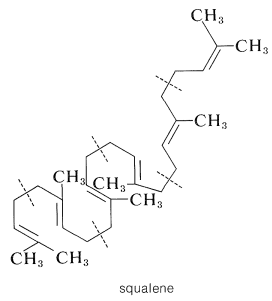
Cuando el escualeno está escrito en esta forma, vemos que está bellamente construido para la ciclación a lanosterol. El intermedio clave que inicia la ciclación es el 2,3-epóxido de escualeno. La escisión enzimática del anillo epóxido es seguida por ciclación y luego se\(\left( \ce{CH_3} \colon \right)\) desplaza el múltiple de hidruro\(\left( \ce{H} \colon \right)\) y metido para dar lanosterol:
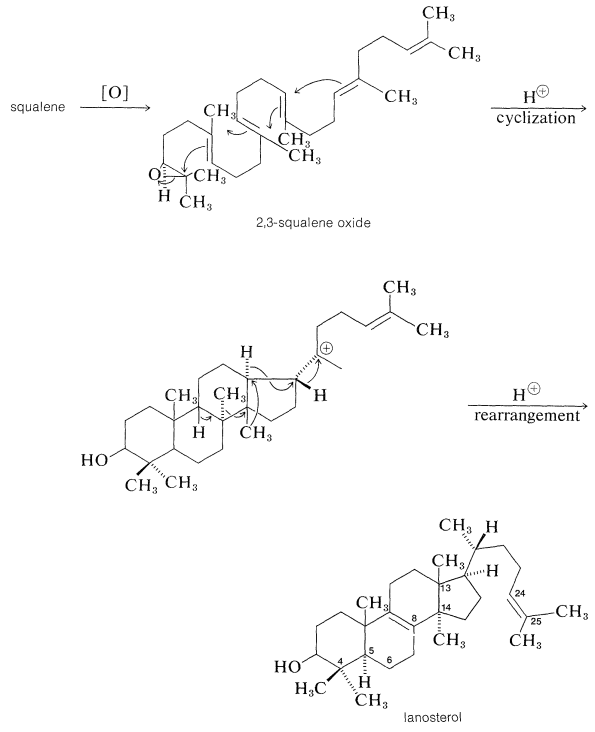
La evidencia es contundente de que la biosíntesis del lanosterol en realidad procede por una vía de este tipo. Con escualeno hecho de etanoato marcado con metilo o carboxilo, todos los carbonos del lanosterol y colesterol se etiquetan tal como se predice a partir del mecanismo. Además, ingeniosos experimentos de doble marcaje han demostrado que el metil at\(\ce{C_{13}}\) del lanosterol es el que originalmente se localizó\(\ce{C_{14}}\), mientras que el at\(\ce{C_{14}}\) es el que proviene\(\ce{C_8}\).
La conversión de lanosterol en colesterol implica la eliminación de los tres grupos metilo en las posiciones 4,4 y 14, desplazamiento del doble enlace en la\(C\) unión\(B\)/entre\(\ce{C_5}\) y\(\ce{C_6}\), y reducción del\(\ce{C_{25}}\) doble enlace\(\ce{C_{24}}\) -. Los grupos metilo se indican mediante experimentos trazadores para ser eliminados por oxidación a dióxido de carbono.
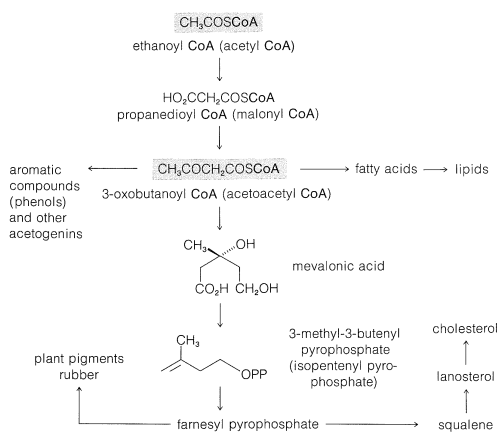
La conexión biosintética entre la etanoil coenzima A y los productos naturales complejos discutidos brevemente se resume en la Figura 30-1.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


