30.4: Esteroides
- Page ID
- 72739
El término esteroide se aplica a compuestos que contienen esqueleto de carbono de ciclopentanofenantreno hidrogenado:
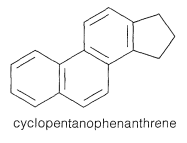
La mayoría de los esteroides son alcoholes y, en consecuencia, se denominan esteroles. Ejemplos importantes incluyen colesterol, ergosterol, estradiol, estigmasterol y otros esteroles representativos dados en la Tabla 30-2. Como se puede ver en sus estructuras, la mayoría posee el mismo esqueleto anular pero varían considerablemente en sus características estructurales periféricas, estereoquímica y en el grado de insaturación del anillo.
Cuadro 30-2: Esteroides Representativos
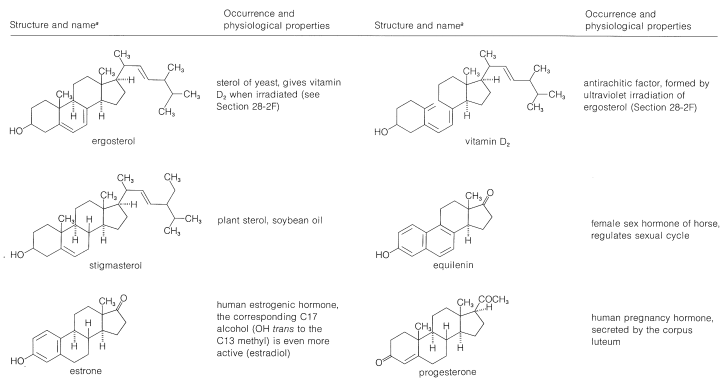
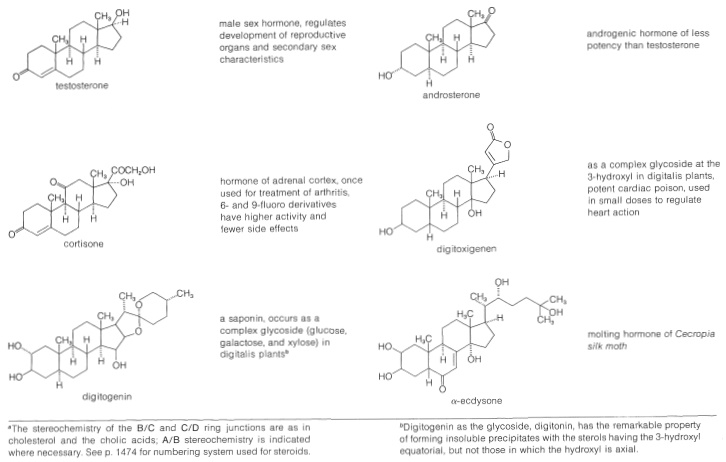
Los esteroles están ampliamente distribuidos tanto en plantas como en animales. Muchos son de vital importancia para la fisiología animal, como el colesterol, los ácidos biliares, la vitamina D, las hormonas sexuales y las hormonas corticoides. Muchos tienen valor como medicamentos, como los glucósidos cardíacos, las hormonas y los antibióticos esteroideos. La ocurrencia y las propiedades fisiológicas de los esteroides representativos se incluyen en el Cuadro 30-2.
Colesterol
El colesterol es un alcohol insaturado de fórmula\(\ce{C_{27}H_{45}OH}\) que desde hace tiempo se sabe que es el principal constituyente de los cálculos biliares humanos y ha recibido notoriedad en los últimos años por su conexión con dolencias circulatorias, particularmente el endurecimiento de las arterias. El colesterol, ya sea libre o en forma de ésteres, en realidad está ampliamente distribuido en el cuerpo, particularmente en el tejido nervioso y cerebral, del cual constituye aproximadamente una sexta parte del peso seco. No se entiende la función del colesterol en el cuerpo; los experimentos con colesterol etiquetado indican que el colesterol en el tejido nervioso y cerebral no se equilibre rápidamente con el colesterol administrado en la dieta. Dos cosas están claras: el colesterol se sintetiza en el cuerpo y su metabolismo está regulado por un conjunto altamente específico de enzimas. La alta especificidad de estas enzimas se puede juzgar por el hecho de que los esteroles vegetales muy estrechamente relacionados, como el sitosterol, no son metabolizados por los animales superiores, a pesar de que tienen la misma configuración estereoquímica de todos los grupos en el anillo y difieren en estructura solo cerca del final del cadena lateral:
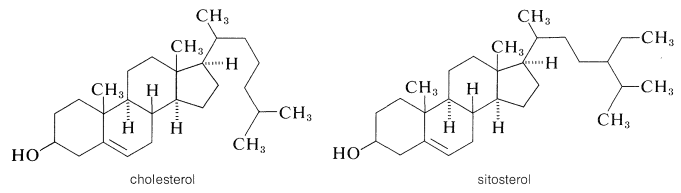
El sistema de numeración aceptado para el núcleo esteroide y las cadenas laterales unidas se ilustra para el colesterol en\(4\). Los grupos metilo en la unión de anillos\(A\)\(B\)\(\left( \ce{C_{10}} \right)\) y anillos\(C\) y\(D\)\(\left( \ce{C_{13}} \right)\) se denominan metilos angulares. Para evitar una mala interpretación de la estructura y la estereoquímica, los grupos metilo y los hidrógenos en las uniones de anillos deben escribirse explícitamente como\(\ce{CH_3}\) o\(\ce{H}\). La estereoquímica se especifica mediante una línea continua si el átomo o grupo está por encima del plano del anillo\(\left( \beta \right)\), y por una línea discontinua si está por debajo del plano del anillo\(\left( \alpha \right)\). Así compuesto\(5\),\(\alpha\)\(\beta\) 5-colestan-3-ol, que se obtiene por la reducción del colesterol, implica en el nombre que el hidroxilo at\(\ce{C_3}\) está por encima del plano del anillo y que el hidrógeno at\(\ce{C_5}\) está por debajo del plano del anillo (es decir, los\(A\)/\(B\)anillos, tienen la estereoquímica trans - decalina; Sección 12-9).
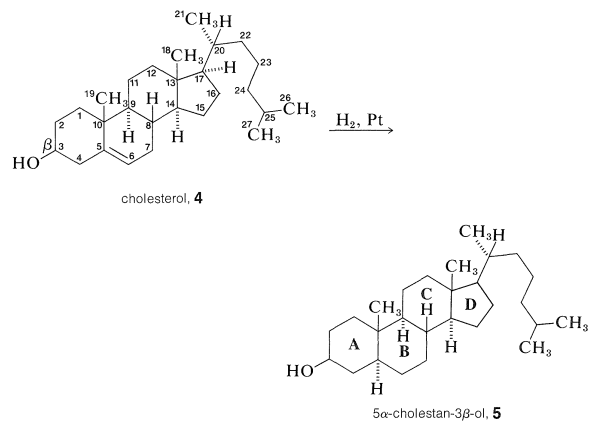
Estructura del Colesterol
Aunque el colesterol fue reconocido como una sustancia química individual en 1812, todos los aspectos de su estructura y configuración estereoquímica no se asentaron hasta alrededor de 1955. El problema estructural fue muy difícil, ya que la mayor parte del colesterol está saturado y no se degrada fácilmente. Afortunadamente, el colesterol está fácilmente disponible, por lo que fue posible utilizar secuencias degradativas bastante elaboradas, lo que habría estado bastante fuera de discusión con algunos de los productos naturales más raros.
El primer paso en la elucidación de la estructura del colesterol fue la determinación de la fórmula molecular, primero incorrectamente como\(\ce{C_{26}H_{44}O}\) en 1859 y luego correctamente como\(\ce{C_{27}H_{46}O}\) en 1888. La precisión requerida para distinguir entre estas dos fórmulas es bastante alta, porque\(\ce{C_{26}H_{44}O}\) tiene\(83.80\%\)\(\ce{C}\) y\(11.90\%\)\(\ce{H}\), mientras que\(\ce{C_{27}H_{46}O}\) tiene\(83.87\%\)\(\ce{C}\) y\(11.99\%\)\(\ce{H}\). En 1859 se demostró que el colesterol era un alcohol por formación de derivados éster y en 1868 poseía un doble enlace por formación de un dibromuro. Para 1903 se indicó que la función alcohol era secundaria por oxidación a una cetona en lugar de a un aldehído. La presencia del grupo hidroxilo y doble enlace al combinarse con la fórmula molecular mostró la presencia de cuatro anillos carbocíclicos. Un mayor avance solo fue posible por la degradación oxidativa.
La prueba de estructura para el colesterol fue paralela a la de otros dos esteroides importantes, los llamados ácidos biliares, ácido cólico y desoxicólico, que funcionan para ayudar a solubilizar las grasas en el tracto intestinal. La prueba de que el colesterol y los ácidos biliares tienen el mismo sistema general de anillos se logró por deshidratación y reducción del colesterol a dos hidrocarburos diferentes, \(\alpha\)5-colestano y \(\beta\)5-colestano (coprostano), los cuales difieren solo en la estereoquímica de la unión entre anillos\(A\) y\(B\):
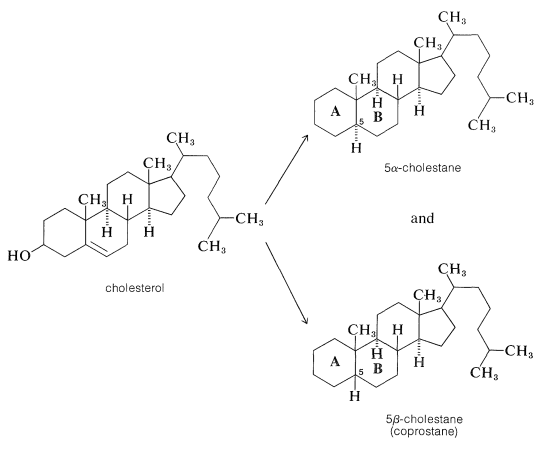
La oxidación del\(\beta\) 5-colestano, pero no del\(\alpha\) 5-colestano, dio un ácido que resultó ser idéntico al ácido colánico obtenido por deshidratación del ácido cólico\(300^\text{o}\) seguido de hidrogenación:
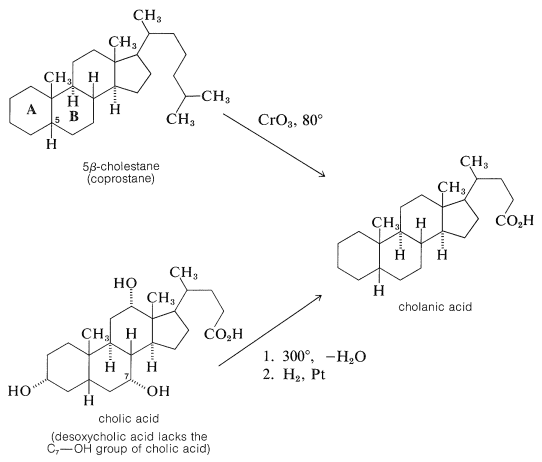
Una vez establecida la conexión entre el colesterol y los ácidos biliares, se siguió trabajando en la prueba de estructura hacia experimentos de degradación en los ácidos biliares que, con sus grupos hidroxilo en anillos\(B\) y\(C\), ofrecieron más reacciones de degradación posibles que el colesterol. Los químicos alemanes H. Wieland y A. Windaus hicieron contribuciones sobresalientes para la prueba de estructura, quienes fueron honrados con la entrega del Premio Nobel de Química. Wieland recibió el premio en 1927 y Windaus en 1928. A pesar de sus muchos años de esfuerzo, la estructura propuesta por Windaus en 1928 para el ácido desoxicólico fue solo tentativa y no específica en cuanto a la ubicación de dos carbonos.
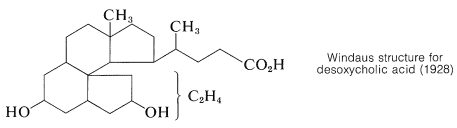
Las serias dudas sobre la corrección de la estructura Windaus surgieron como resultado de un estudio de rayos X del ergosterol realizado por J. D. Bernal en 1932. Señaló que la evidencia de rayos X indicaba que el ergosterol era una molécula larga, bastante plana. Los esteroides con el sistema de anillos correspondiente a la estructura Windaus tendrían una forma globular. Esta observación estimuló un mayor trabajo y un reexamen de la evidencia que finalmente condujo a la correcta estructura. Los detalles de esta investigación se pueden encontrar en otra parte. \(^3\)
Síntesis de esteroides
Uno de los logros más notables de la década de 1950 fue la síntesis total de una serie de esteroides importantes, incluyendo estrona, colesterol, cortisona, androsterona y testosterona. Los cursos de algunas de estas síntesis son extraordinariamente complejos e implican un gran número de pasos. Si bien no han superado a la Naturaleza en proporcionar cantidades prácticas de esteroides sintéticos, han llevado al desarrollo de reacciones clave de uso general en la síntesis orgánica. Una reacción especialmente útil para construir sistemas de anillos fusionados es la llamada reacción de annelación Robinson desarrollada por Sir Robert Robinson (Premio Nobel, 1947) y J. W. Cornforth (Premio Nobel, 1975). La reacción implica una adición de Michael a una\(\alpha\) cetona\(\beta\) insaturada seguida inmediatamente de una adición aldólica:
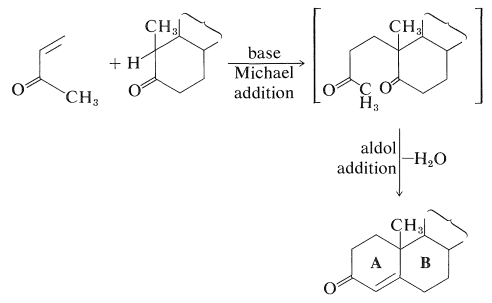
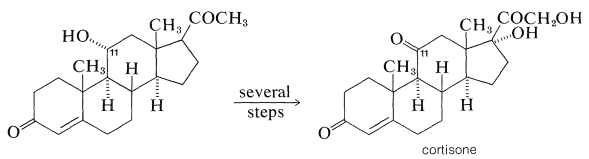
La importancia farmacológica de muchos esteroides naturales ha estimulado mucho trabajo sintético en un esfuerzo por obtener cantidades prácticas de esteroides naturales y no naturales. A menudo, una combinación de biosíntesis y síntesis orgánica funciona mejor. Por ejemplo, la necesidad de grandes cantidades de derivados de cortisona para uso terapéutico en el tratamiento de la artritis y enfermedades metabólicas similares ha llevado a una investigación intensiva sobre enfoques sintéticos para métodos de producción de esteroides con funciones de oxígeno en\(\ce{C_{11}}\), que no es un punto particularmente común de sustitución en esteroides.
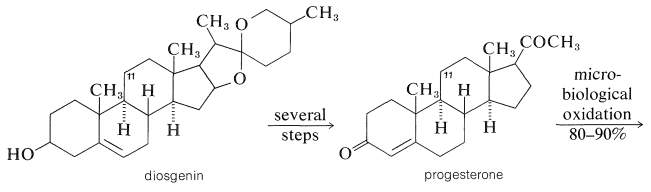
Una forma eficiente de hacerlo es mediante oxidación microbiológica. La cortisona se puede fabricar a una escala relativamente grande a partir de la saponina, la diosgenina, la cual se aísla de tubérculos de un ñame mexicano del género Dioscorea. La diosgenina se convierte en progesterona, luego por una oxidación de alto rendimiento (\(80\%\)-\(90\%\)) con el moho, Rhizopus nigricans, a 11-hidroxiprogesterona y finalmente a cortisona:
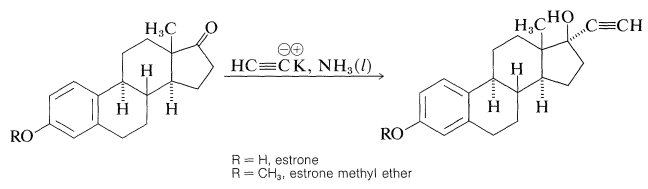
Derivados esteroideos especialmente importantes en uso hoy en día son los estrógenos sintéticos, 17-\(\alpha\) -etinilestradiol y su\(\ce{OCH_3}\) derivado 3-, el mestranol:

Ambos compuestos tienen una potente actividad estrogénica (inhiben la ovulación) y son ampliamente utilizados como anticonceptivos orales. Se sintetizan a partir del estrógeno natural, la estrona, mediante la siguiente reacción:
Un compuesto conocido como dietilestilbestrol (DES) también exhibe actividad estrogénica aunque no está relacionado estructuralmente con los estrógenos esteroideos. Ha adquirido notoriedad como posible causa de cáncer uterino. El dietilestilbestrol se ha utilizado ampliamente como aditivo en la alimentación de ganado bovino y pollo, ya que da una mayor ganancia de peso para una cantidad dada de alimento.

\(^3\)Véase, por ejemplo, el excelente y autoritario relato dado por L. F. Fieser y M. Fieser, Steroides, Van Nostrand Reinhold Co., Nueva York, 1959, Capítulo 3.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


