31.2: Otros Compuestos Organometálicos de Metales de Transición
- Page ID
- 73467
\(\pi\)Complejos de Alqueno y Cicloalqueno Tipo
No todos los compuestos organometálicos de los metales de transición datan del descubrimiento del ferroceno. Muchos se conocen desde hace mucho tiempo pero sus estructuras no se entendieron. Un ejemplo conspicuo es el anión de una sustancia conocida como sal de Zeise, que se forma a partir de la reacción del etanol con ácido cloroplatínico,\(\ce{H_2PtCl_6}\). El anión tiene la fórmula\(\ce{Pt(C_2H_4)Cl_3^-}\). Aunque se conoce desde 1830, finalmente se demostró que tenía una estructura con ambos carbonos de eteno unidos al platino. La unión carbono-metal generalmente se formula como un\(\pi\) complejo\(11a\), o complejo de transferencia de carga (Sección 22-4D). Alternativamente, podemos pensar en el enlace entre el platino\(11a\) como un ácido de Lewis (aceptor de pares de electrones) y el eteno como una base de Lewis (donador de pares de electrones):
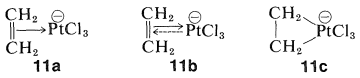
La flecha en\(11a\) simboliza la donación de\(\pi\) electrones. Sin embargo, debido a que la estabilidad del ion es mucho mayor de lo que se esperaría para un simple complejo ácido-base o de transferencia de carga, se postula que\(d\) los electrones no compartidos del metal participan en la unión. Esto está simbolizado por la flecha discontinua en\(11b\), que significa donación de\(d\) electrones al\(\pi^*\) orbital del doble enlace o, como a menudo se le llama, “unión posterior”. Quizás lo más simple es\(11c\), donde el\(\ce{C-Pt}\) enlace se formula como un anillo de tres miembros con enlaces esencialmente\(\ce{C-Pt}\) (\ sigma\). En esta formulación se asume la plena participación de un par de electrones de platino.
Actualmente se conocen muchos complejos de alquenos, cicloalquenos, alquinos y cicloalquinos con metales de transición. Algunos ejemplos son:
.png)
Muchas sustancias de este tipo tienen potencial utilidad sintética como catalizadores o como reactivos.
Enlaces de metal de transición de alquilo
Los compuestos organometálicos de metales de transición con enlaces alquilo a metal durante muchos años fueron considerados como sustancias altamente inestables y propensas a la disociación en radicales que se acoplarían o desproporcionarían, como ilustra la siguiente secuencia:
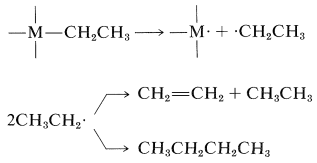 \(\tag{31-1}\)
\(\tag{31-1}\)
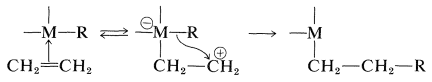
El hecho es que la estabilidad depende del carácter de los grupos alquilo unidos. Los compuestos de metales de transición con\(\ce{CH_3}-\)\(\ce{(CH_3)_3CCH_2}-\), y los\(\ce{C_6H_5CH_2}-\) grupos son en muchos casos mucho más estables que aquellos con\(\ce{CH_3CH_2}-\)\(\ce{(CH_3)_2CH}-\), y\(\ce{(CH_3)_3C}-\) grupos, aunque se esperaría que la facilidad de formación de radicales por disociación fuera especialmente favorable con el\(\ce{C_6H_5CH_2}-\) grupo. Además, las descomposiciones que dan alqueno e hidruro metálico o productos de desproporción (alqueno y alcano) pueden fallar en dar productos de acoplamiento por completo. Estos hechos y muchos otros indican que un modo importante de descomposición de una variedad de compuestos de metales de transición sustituidos con alquilo no procede por un mecanismo radical. En cambio, hay una transferencia de un\(\beta\) hidrógeno del grupo alquilo al metal para formar un complejo alqueno\(\pi\) tipo y un enlace metal-hidruro. La descomposición de este complejo produce el alqueno y el hidruro metálico. Estos cambios son reversibles.
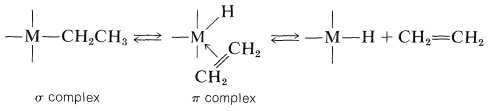
La formación del alcano puede ser el resultado de la escisión de un enlace alquil-metal por el hidruro metálico:
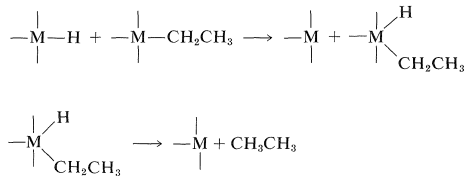
Este mecanismo pero no la secuencia de la Ecuación 31-1 deja claro por qué\(\ce{CH_3}-\),\(\ce{(CH_3)_3CCH_2}-\), y\(\ce{C_6H_5CH_2}-\) son estables unidos a los metales de transición, debido a que cada uno de estos sustituyentes carece de un\(\beta\) hidrógeno que permita la formación\(\pi\) de un complejo unido. La reacción de desplazamiento de hidruro es especialmente importante en las reacciones de hidrogenación y carbonilación, como se mostrará en la Sección 31-3. De hecho, el reordenamiento reversible de\(\pi\) a\(\sigma\) complejos tiene una amplia generalidad e incluye desplazamientos de alquilo así como desplazamientos de hidruro. Un ejemplo importante del mecanismo de desplazamiento de alquilo es la polimerización de eteno por catalizadores Ziegler-Natta (\(\ce{R_3Al}\)y\(\ce{TiCl_4}\)); la secuencia de construcción de cadenas se da en la Sección 29-6A.
Para entender estas reacciones, es útil ver el\(\pi\) complejo metal-alqueno como un carbocatión incipiente (así como\(\pi\) los complejos de halógenos son carbocationes incipientes). Los desplazamientos de alquilo e hidruro entonces llevan analogía a los reordenamientos de carbocationes. Esto puede ser una simplificación excesiva pero hace que la química sea más fácil de seguir.
En otras reacciones, veremos que el metal puede actuar como reactivo nucleofílico.
Complejos Carbeno-Metal
La unión entre un átomo de metal de transición y un\(sp^2\) carbono hibridado se puede representar por las siguientes estructuras de enlace de valencia:
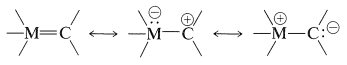
Se conocen complejos estables de metal de transición de este tipo y otros se han reconocido como probables intermedios en varias reacciones. Con razón o equivocadamente, se les llama complejos carbeno-metal, aunque también pueden considerarse como carbocationes estabilizados con metales o como iluros estabilizados con metales (Sección 16-4A).
Quizás los ejemplos más comunes de este tipo de unión carbono-metal son los carbonilos metálicos, en los que el ligando de monóxido de carbono funciona como el “carbeno”:
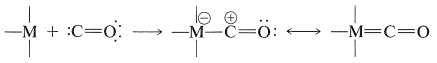
Cuando se representa de esta manera, la química de los complejos carbonílicos de los metales de transición se vuelve más fácil de entender. Las reacciones de hidroformilación y otras carbonilaciones que son catalizadas por complejos de metales de transición frecuentemente implican transferencias de hidruro o alquilo desde el átomo de metal al carbono carbonilo “positivo” (Secciones 16-9G, 31-3 y 31-4):
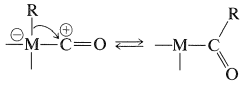
Ahora se procede a describir algunas reacciones seleccionadas que pueden ser entendidas dentro de este marco de unión tipo\(\sigma\)\(\pi\) -, -, y carbeno-tipo entre el metal y el carbono.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


