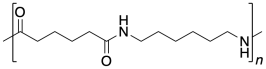
1.1: Carboxiloides difuncionales
- Page ID
- 71905
El primer polímero sintético que realmente se apoderó de la conciencia del público —el primero en cambiar el rumbo de los acontecimientos mundiales— fue el nylon. Poco después de su descubrimiento en la década de 1930, había suplantado la seda como el material de elección para las medias, habiendo transformado un artículo de lujo en una mercancía ampliamente disponible. El nylon llegó justo a tiempo para la Segunda Guerra Mundial. Pronto, los paracaídas, también, pasaron de estar hechos de seda a ser fabricados con nylon.
El desarrollo del nylon tuvo lugar en la Estación de Investigación Experimental de Du Pont en Delaware. Durante gran parte del siglo XX, Du Pont y otras grandes empresas confiaron en la búsqueda de la ciencia básica como motor de desarrollo futuro. El conocimiento era la infraestructura que hacía posibles productos futuros, por lo que se pidió a los científicos que exploraran lo desconocido; las aplicaciones de este trabajo seguirían de forma natural.
Cuando Wallace Carrothers de Du Pont desarrolló nylon, había estado tratando de explorar algunas ideas propuestas por Hermann Staudinger en ETH Zurich. Estas ideas, inicialmente polémicas, sostenían que muchos materiales a nuestro alrededor, incluyendo cosas como el algodón y la seda de araña, están hechos de pequeñas unidades moleculares unidas covalentemente entre sí. Estas pequeñas moléculas, los monómeros, se unen para formar cadenas inmensamente largas. Al hacerlo, los monómeros pierden sus identidades individuales y simplemente se convierten en unidades repetitivas en una cadena larga. Se unen para formar polímeros.
El nylon, en particular, es un ejemplo de poliamida. Está compuesta por cadenas muy largas que contienen enlaces amida que se repiten regularmente, N-C=O, ese es el mismo motivo que se encuentra en las proteínas en biología, y es el mismo patrón que se encuentra en la seda de araña, que está compuesta por proteínas.

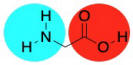
Conceptualmente, se nos enseña en clase de biología que las proteínas están hechas de aminoácidos. Un enlace amida (o enlace peptídico) ocurre cuando el nitrógeno de una amina se une con el carbono de un ácido carboxílico. Se pierde una molécula de agua, y el nitrógeno toma el lugar del oxígeno en el ácido carboxílico, formando una amida, en cambio. La pérdida de agua lleva al término “reacción de condensación” porque los primeros estudios de estas reacciones llevaron a que el agua formara gotas en la cristalería de laboratorio a medida que burbujeaba fuera de la reacción. En la práctica, la producción industrial de nylon no es realmente más complicada que eso.
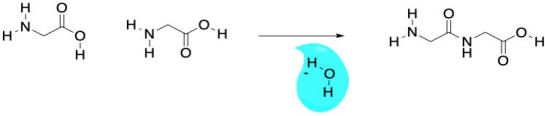
Por supuesto, no cualquier amida vieja puede convertirse en una proteína. Lo que hace que los aminoácidos sean especiales es el hecho de que son difuncionales. Contienen no solo un grupo funcional (una amina, digamos, o un ácido carboxílico), sino dos. Entonces, cuando el grupo amina de un aminoácido se une con el carbonilo de un vecino, el grupo carboxilo puede unirse a la amina de un vecino diferente. Es como que tiene dos manos; puede aferrarse a un amigo con cada mano, y cada uno de esos amigos puede aferrarse a otro, y así sucesivamente, formando una cadena.
Esta funcionalidad es una parte clave de cómo se pueden formar los polímeros. Debido a que las moléculas difuncionales pueden formar enlaces en dos direcciones, una simple reacción de acoplamiento (una amina más un ácido carboxílico que hace una amida, dos moléculas pequeñas que hacen otra molécula pequeña) se convierte en una polimerización (muchas moléculas pequeñas que forman una molécula enorme).
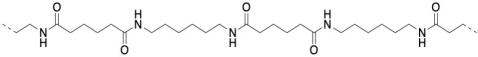
Bueno, el nylon no está hecho de un aminoácido, aunque la reacción de acoplamiento es similar. En cambio, está hecho de dos moléculas diferentes, ambas difuncionales: una diamina y un ácido dicarboxílico. La diamina se une a un carbonilo vecino a través de cada extremo y el ácido dicarboxílico se une a una amina vecina a través de cada extremo. Para el material más común, cada uno de los dos reactivos tiene seis carbonos de largo, dando lugar al término “nylon 66".
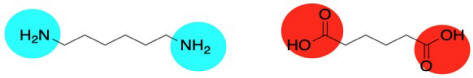
El Nylon 66 es un ejemplo de algo llamado copolímero alterno. No es sólo una unidad repitiendo una y otra vez a lo largo de una cadena, sino dos. Los dos monómeros forman el polímero juntos. A veces decimos que los monómeros se encauzan cuando pasan a formar parte de un polímero. Y claro, tienen que alternarse a lo largo de la cadena, para que uno pueda unirse al otro complementario.
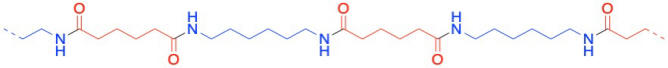
En los dibujos anteriores, las líneas discontinuas pretenden sugerir continuidad: el patrón mostrado en el dibujo sigue repitiéndose hacia la derecha y hacia la izquierda. Más comúnmente, los polímeros se dibujan usando notación entre paréntesis. A continuación, la parte que se muestra entre paréntesis es lo que sigue repitiéndose. Si pudiéramos hacer un sello de esa imagen, podríamos construir la cadena de polímero simplemente estampando esa imagen una y otra vez a través de una hoja de papel.