2.4: polimerización catiónica
- Page ID
- 71953
Los alquenos, u olefinas, son probablemente la materia prima polimérica más común. Los enlaces pi de los alquenos son inherentemente nucleofílicos. La adición de un electrófilo a un alqueno da como resultado la escisión del enlace pi, con los electrones atraídos hacia el electrófilo y, en consecuencia, se puede dejar un catión en un extremo del doble enlace anterior.
Si el catión resultante interactúa con otro alqueno, se produce otra reacción electrófila, y así sucesivamente, conduciendo a la polimerización. Debido a la presencia de un intermedio catiónico clave a lo largo de la ruta de reacción, este método de polimerización se llama polimerización catiónica. Es un ejemplo de una reacción en cadena que es iniciada por una especie catiónica.
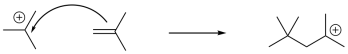
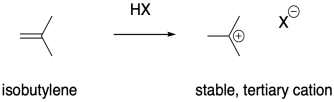
Es lógico pensar que los alquenos que forman cationes estables serían particularmente susceptibles a la polimerización a través de métodos catiónicos. Los cationes son intermedios de alta energía, por lo que si un catión es relativamente fácil de formar entonces la barrera para el proceso se reduce considerablemente. El isobutileno, (CH 3) 2 C=CH 2, es un buen ejemplo de un alqueno que formaría un catión estable tras la protonación. La estabilidad relativa de los cationes más sustituidos dicta que la carga positiva se encuentre en una posición terciaria.
El grado de sustitución es solo una forma de estabilizar los carbocationes. La conjugación también es un factor importante en la estabilidad catiónica. Los alquenos que dan lugar a cationes deslocalizados también son buenos candidatos para la polimerización catiónica. El estireno, PhCH=CH 2, así como el butadieno, CH 2 =CHCH=CH 2, y el producto natural relacionado isopreno, CH 2 =C (CH 3) CH=CH 2, pueden polimerizarse utilizando métodos catiónicos.
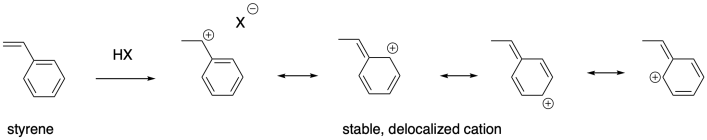
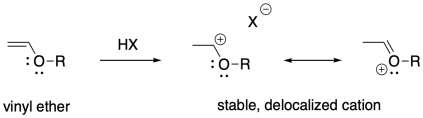
Estos ejemplos se estabilizan por deslocalización alílica: el catión es parte de un sistema que contiene una característica C=C-C +, la cual se deslocaliza como + C-C=C; los cationes también se pueden estabilizar mediante pi-donación. El oxígeno y el nitrógeno son particularmente buenos donantes pi hacia los carbocationes, por lo que los sustituyentes de oxígeno y nitrógeno en los alquenos hacen que estos compuestos sean susceptibles a la polimerización catiónica Los éteres vinílicos, por ejemplo, se pueden polimerizar de esta manera.
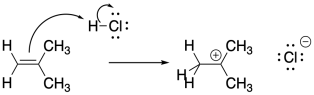
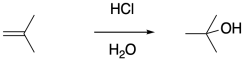
La manera obvia de iniciar estas polimerizaciones es a través de la adición de un ácido fuerte. La protonación del alqueno ciertamente debería resultar en la formación de un carbocatión. Sin embargo, los ácidos fuertes más comunes son los ácidos minerales, que se encuentran típicamente en medios acuosos. La presencia de agua nucleofílica cubriría rápidamente el carbocatión antes de que pudiera realizarse la polimerización.
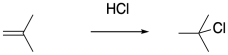
Por supuesto, el cloruro de hidrógeno no requiere agua como disolvente. La adición de gas HCl seco a la olefina de interés debería dar como resultado la formación de cationes sin hidratación posterior. Desafortunadamente, solo la presencia del ion cloruro, que también puede actuar como nucleófilo, condena la polimerización a una muerte temprana.
Hay otros ácidos menos nucleofílicos que no son tan fuertemente propensos a la adición clásica a través de un alqueno en comparación con la medida en que nos asociamos con HCl. Me vienen a la mente ácido sulfúrico y diversos ácidos sulfónicos. Incluso en estos casos, sin embargo, la polimerización está limitada por el colapso eventual del nucleófilo con el extremo de la cadena catiónica.
En lugar de usar ácidos fuertes de Brønsted para iniciar la polimerización, en realidad es muy común usar ácidos de Lewis. Los ácidos de Lewis no pueden iniciar la polimerización catiónica directamente, pero pueden coiniciar la reacción en presencia de una impureza de agua, por ejemplo. El ácido de Lewis activa el agua hacia la liberación de un protón. El protón inicia entonces la reacción. Las trazas de HCl también pueden actuar como el iniciador cuando se emplea un coiniciador de ácido de Lewis, porque el ácido de Lewis une el ion cloruro para que no pueda conectarse con el extremo de la cadena catiónica en crecimiento.
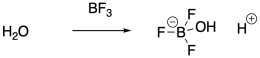
Los iniciadores próticos no son estrictamente necesarios para la polimerización catiónica. Los ácidos de Lewis fuertes también son capaces de activar haluros de alquilo. El carbocatión resultante puede entonces iniciar la reacción en cadena de polimerización.
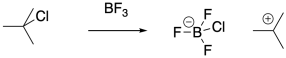
Incluso en estos sistemas, hay eventos de terminación de cadena que destruyen el intermedio reactivo y detienen la polimerización. Como se indicó anteriormente, la combinación de un anión nucleófilo con el extremo de la cadena catiónica es un destino común de los polímeros en crecimiento. Los iones haluro, liberados en equilibrio del complejo ácido-base de Lewis, siguen siendo un posible problema, aunque este evento es mucho menos probable en presencia de coiniciadores ácidos de Lewis. Otros aniones similares, como los aniones hidróxido en polimerizaciones iniciadas por agua, pueden desempeñar un papel similar.

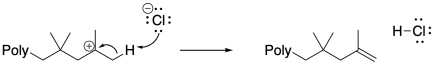
Las especies aniónicas también pueden llevar a cabo eliminaciones beta en extremos de cadena catiónica. La beta-eliminación da como resultado la pérdida del intermedio catiónico, reemplazándolo por un elceno final de caína. Ese evento da como resultado la producción de un nuevo iniciador, y aunque se podría argumentar que el iniciador podría simplemente reiniciar la misma cadena polimérica, dadas las concentraciones relativas es mucho más probable que el iniciador transfiera el protón a un nuevo monómero. En ese caso, una nueva cadena de crecimiento comienza de cero y comienza a acumular monómeros.
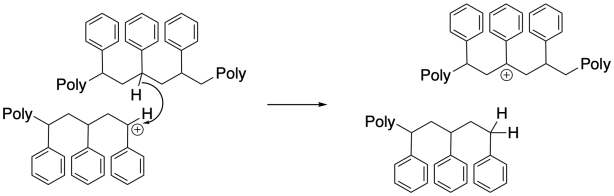
Sorprendentemente, los eventos de transferencia en cadena son otro modo común de terminación. En estos casos, un hidruro debe transferirse de una cadena a otra, o de una posición a lo largo de la cadena principal hasta el extremo de la cadena en crecimiento. Esta inusual transferencia de hidruro probablemente se ve facilitada por una distancia de contacto muy estrecha entre dos cadenas, o entre dos segmentos de una cadena, en un medio de polimerización concentrada. Como resultado, un extremo de cadena deja de crecer, y la cadena comienza a crecer desde una nueva posición a lo largo de su columna vertebral. Este evento da como resultado la ramificación de la cadena, cambiando la morfología y las propiedades del polímero.
Normalmente, suponiendo una etapa de iniciación relativamente rápida (formación de un catión a partir del primer monómero), el crecimiento de las cadenas poliméricas en tándem procederá aproximadamente a la misma velocidad, de modo que todas las cadenas alcancen longitudes similares en el momento en que se hayan consumido todos los monómeros. ¿Qué pasa si algunas de esas cadenas mueren prematuramente? Otras cadenas continúan creciendo a longitudes más largas. Como resultado, hay una distribución más amplia de longitudes de cadena, o pesos moleculares, de lo que habría de otra manera. Una distribución más amplia del peso molecular significa que las propiedades físicas del material pueden ser menos reproducibles.
En un proceso de polimerización típico, a la reacción le sigue un temple, en el que se agrega algún agente que detendrá la polimerización adicional. En las polimerizaciones catiónicas, la inactivación se puede lograr mediante la adición de ácido acuoso, ya que el agua o el conjugado del ácido destruirán el catión. El material suele precipitarse en un disolvente que puede disolver cualquier monómero restante, pero no polímero. Debido a que algunas cadenas pueden haber muerto muy temprano, también podrían permanecer en solución, dejando solo cadenas más grandes en el precipitado.
Ejercicio 2.4.1
Elija el catión más estable de cada uno de los siguientes grupos. Proporcionar una razón para la estabilidad de ese catión.
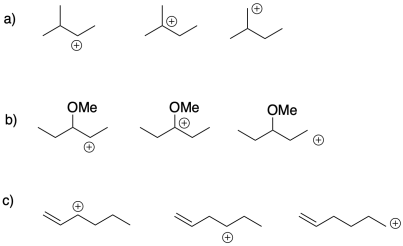
Ejercicio 2.4.2
En cada grupo, seleccione el alqueno más adecuado para la polimerización catiónica.
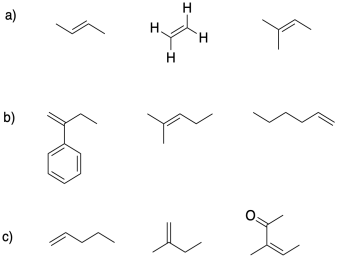
Ejercicio 2.4.3
Proporcionar un mecanismo para la formación de un iniciador prótico a partir de la interacción del trifluoruro de boro con el agua.
Ejercicio 2.4.4
Anetol en un compuesto de origen natural que ha sido utilizado en polimerizaciones catiónicas. Mostrar por qué el anetol debe ser un buen monómero para este método.
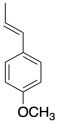
Ejercicio 2.4.5
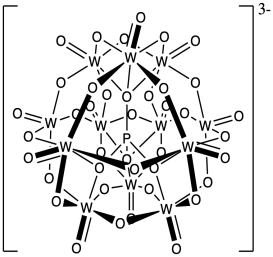
Fosfotungstatos como H 3 PW 12 O 40 han sido utilizados como iniciadores catiónicos y no muestran mucha terminación por el contraión, a continuación. Proponer una razón de la baja nucleofilia de este contraión para la cadena catiónica en crecimiento.