2.6: Polimerización aniónico
- Page ID
- 71974
Si has estudiado alguna química orgánica, entonces parece obvio que se emplearían métodos catiónicos para la polimerización de alquenos. Después de todo, los alquenos son nucleofílicos, por lo que deben reaccionar fácilmente con iniciadores catiónicos. Podría ser sorprendente que haya una serie de polimerizaciones de alquenos que funcionan muy bien usando iniciadores aniónicos.
Uno de los escenarios más comunes para este enfoque es en la polimerización de hidrocarburos conjugados, como el estireno. Desde el punto de vista de las estructuras de Lewis, esto parece una combinación divertida. No hay electrófilo obvio en un alqueno; ni siquiera en uno conjugado. ¿Por qué interactuaría con un iniciador aniónico?

Un tratamiento orbital molecular de sistemas conjugados proporciona una respuesta. Cuando se conjugan alquenos, suceden varias cosas. Existe al menos un orbital de enlace π extendido que se mueve a menor energía debido a la conjugación, y pensamos en ese factor para explicar la estabilidad relativa de los alquenos conjugados hacia los electrófilos, en comparación con la reactividad de los alquenos aislados. Al mismo tiempo, también hay orbitales de enlace π que se elevan un poco en energía así como orbitales π*- o π-antienlace correspondientes que son rebajados de energía por conjugación. Esta característica explica el conocido cambio en la absorción óptica de alquenos conjugados hacia la región visible del espectro; vemos que en compuestos de colores brillantes como caroteno y xantofilas en hojas de otoño. Es en parte esa disminución del Orbital Molecular Unnocupied más bajo (LUMO) que conduce al aumento de la electofilicidad de los alquenos conjugados en comparación con los alquenos regulares.
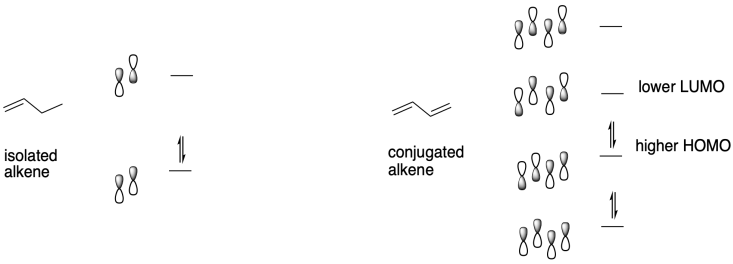
Una vez que un iniciador aniónico se ha agregado a un alqueno conjugado, el alqueno conjugado se convierte en un anión. Eso lleva a la segunda parte de la explicación. Si miras el anión que resulta, encontrarás estabilización de resonancia. Esa deslocalización es siempre un factor poderoso que permite que los iones se formen más fácilmente. De hecho, podemos elegir fácilmente un iniciador aniónico que sea más reactivo que el deslocalizado, de manera que haya una fuerza impulsora hacia la iniciación del polímero. Los alquillitios, como el butillitio, son buenos candidatos.
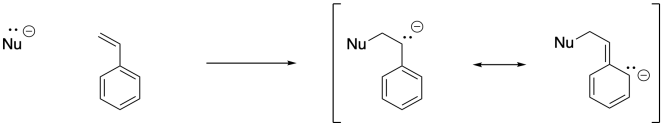
Puede haber otros alquenos que vienen a la mente como potencialmente adecuados para la polimerización aniónica. Nuevamente, si has estudiado química orgánica, podrías ser cosa de 1,4-adición de nucleófilos a enonas conjugadas. También es posible la iniciación aniónica de este tipo de monómeros. La polimerización de acrilato, que involucra monómeros que contienen una unidad C=C-CO 2, es comercialmente muy importante.
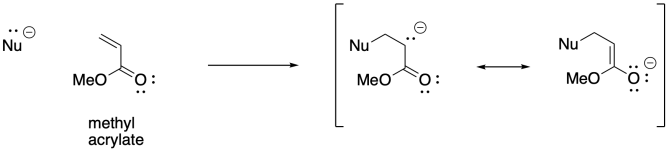
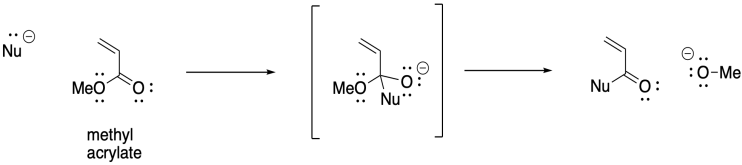
Sin embargo, la adición 1,4-de iniciadores aniónicos no procede tan suavemente como cabría esperar. Este enfoque es propenso a una serie de reacciones secundarias. Por ejemplo, las condensaciones de Claisen resultan en la pérdida de un grupo saliente de alcóxido y la muerte de la cadena.
Por otro lado, la presencia de α-hidrógenos a lo largo del polímero puede conducir a un problema diferente, con la transferencia de protones en equilibrio resultante de la “mordedura”. Este fenómeno conduce a una ramificación incontrolada de la cadena polimérica.
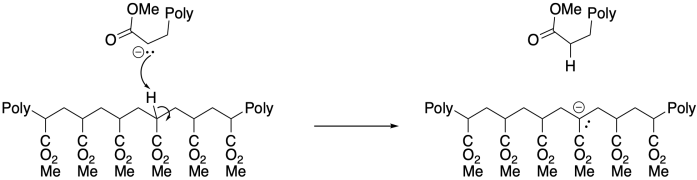
El potencial de reacciones secundarias significa que las polimerizaciones aniónicas son propensas a un control deficiente del peso molecular. Las cadenas que mueren temprano tendrán un peso molecular más bajo que las que continúan creciendo, dando lugar a amplias distribuciones de peso molecular. Al igual que las polimerizaciones catiónicas, las polimerizaciones aniónicas se pueden mejorar en gran medida mediante el uso de métodos vivos.
Problema SM4.1.
La polimerización aniónica del estireno p-sustituido procede muy bien cuando el sustituyente es un grupo aceptor de electrones como el nitrilo. Explicar la razón del éxito de este enfoque.
![]()
Problema SM4.2.
Podría esperarse que el cloruro de vinilo (CH2=CHCl) sea un buen candidato para la polimerización aniónica, pero las reacciones secundarias lo hacen inadecuado.
a) Explicar por qué se podría esperar que el anión resultante muestre cierta estabilidad.
b) Mostrar la reacción secundaria que resultaría en condiciones de polimerización aniónica.

