2.7: Polimerización Aniónica Viva
- Page ID
- 71948
Las reacciones secundarias no deseadas en la polimerización aniónica, como las reacciones de mordedura o Claisen con cadenas de acrilato, conducen a la muerte temprana de la cadena y a una ampliación de la distribución del peso molecular. Este problema es intrínseco al crecimiento del polímero. Debido a que se necesitan extremos de cadena reactivos para encadenar monómeros adicionales, siempre existe el potencial de que estas especies de energía relativamente alta se descarrilen y conduzcan a diferentes productos.
La polimerización viva describe cualquier sistema en el que la muerte temprana de la cadena es limitada, de manera que las cadenas poliméricas pueden continuar creciendo uniformemente. En estos sistemas, el peso molecular aumenta linealmente con el porcentaje de conversión de monómero a polímero. Además, la dispersidad sigue siendo baja incluso a un alto porcentaje de conversión.
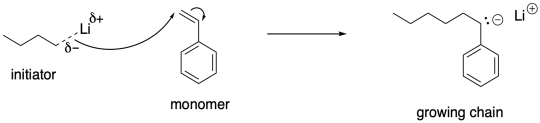
Los extremos reactivos de la cadena en polimerizaciones aniónicas son aniones de carbono nucleofílicos. Si ya has estudiado este tipo de compuestos antes, podría venir a la mente la idea de la covalencia. Los aniones de carbono son más fáciles de trabajar si no son realmente aniones, sino que comparten sus electrones con sus contraiones hasta cierto punto. Entonces, por ejemplo, podríamos optar por emplear contraiones de litio con estos extremos de cadena aniónicos, en lugar de sodio o potasio. El litio más pequeño y electronegativo (al menos comparado con el sodio o el potasio) puede formar un enlace covalente polar con el carbono, estabilizando al nucleófilo.

Por supuesto, incluso un alquil-litio es un nucleófilo lo suficientemente fuerte como para iniciar la polimerización aniónica, siempre que el anión resultante sea más estable que el inicial. En general, puede iniciar la formación de cadenas en crecimiento si el anión resultante es deslocalizado.
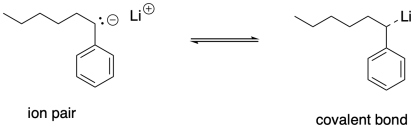
Podemos pensar que las cadenas en crecimiento están en equilibrio entre tener enlaces covalentes de litio-carbono y formar pares de iones. El par iónico estaría más listo para reaccionar con el siguiente monómero. Ese equilibrio podría formar una base para un estado latente y un estado creciente. Al igual que en la polimerización catiónica viva, el estado de crecimiento es necesario para el crecimiento de la cadena del polímero, pero es susceptible a reacciones secundarias no deseadas. El estado latente protege la cadena en crecimiento limitando la concentración de la cadena en crecimiento, limitando consecuentemente el grado de reacciones secundarias.
Entonces, el solo uso de un contraión de litio, por ejemplo, podría esperarse que promueva la polimerización viva, manteniendo baja la dispersidad. Por esa razón, puede ser sorprendente que una de las estrategias utilizadas para el control de cadena en polimerizaciones aniónicas sea agregar alcóxidos de potasio junto con el iniciador de alquillitio. Si las bases de litio tienen mayor covalencia y ofrecen mayor control, ¿por qué agregarías bases de potasio?
Esa pregunta tiene aún más mérito si exploras la historia de las bases de metal mixto. La base de Schlosser es un ejemplo bien precedido. Por lo general, es una mezcla de butillitio y terc-butóxido de potasio. Desarrolladas por Manfred Schlosser en EPF (ETH) Lausanne en Suiza, mezclas de alquilitios y alcóxidos de potasio forman bases poderosas capaces de desprotonar hidrocarburos como el tolueno. Se cree que el mecanismo para lograr una fuerza básica tan alta implica la transferencia de un anión alquilo de litio a potasio. Desde el punto de vista de hacer que las cadenas de cultivo sean más covalentes, proporcionando un estado latente, esto no parece una buena idea. Sin embargo, funciona. ¿Cómo?
Una de las otras características de estas mezclas (Schlosser las llamó bases LiKor, señalando la mezcla de componentes de litio y potasio) es un alto nivel de agregación. Los agregados son grupos de moléculas que se pegan entre sí. Para la base de Schlosser, el agregado simpleto sería una molécula de alquillitio unida a una molécula de terc-butóxido de potasio.
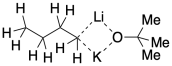
¿Qué mantiene unidos a agregados como este? Los aniones pueden tender puentes entre metales alcalinos. Con el ion alcóxido, eso es fácil de imaginar: el átomo de oxígeno tiene más de un par solitario, por lo que puede donar uno al litio y otro al potasio. Es un poco más difícil ver cómo el anión alquilo, con un solo par solitario, podría hacer eso. Sin embargo, ese tipo de interacción en la que un par solitario se comparte entre dos o más iones de litio, aunque rara, está bastante bien documentado en algunos alquillitios. Es como si el anión alquilo hubiera sido capturado a medio camino entre dos litios, transfiriéndose de uno a otro.
Se podrían formar agregados más grandes si se pegaran moléculas adicionales. Podemos imaginar fácilmente que esto sucede si un alquillitio se combina con dos alcóxidos de potasio.
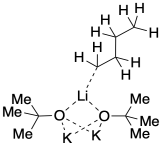
Probablemente puedas imaginar agregados aún más grandes. Tal vez dos alcóxidos se juntan con un alquillitio, mantenidos unidos uniendo oxígenos. De hecho, estas estructuras parecen ser muy dinámicas. Pueden desmoronarse en solución, y pueden unirse para hacer estructuras aún más grandes. En realidad, existirán varios estados de agregación diferentes en equilibrio entre sí, y algunos podrían contener ocho o doce cationes alcalinos junto con sus aniones acompañantes.
Entonces, ¿cuál es el papel de la agregación en la producción de un estado latente? Puede tapar temporalmente el extremo de la cadena en crecimiento, de modo que es menos probable que el extremo de la cadena aniónica interactúe con los monómeros. La reacción ocurriría solo cuando el agregado se rompió, liberando un extremo de cadena aniónica.
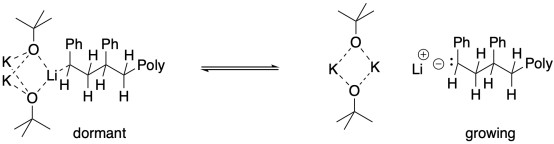
La formación de agregados también puede ser promovida por otros aniones, incluyendo haluros simples como cloruro y fluoruro. Como resultado, la adición de sales simples de litio puede ser efectina en la promoción de la polimerización aniónica viva. La base de alcóxido no tiene por qué jugar un papel.
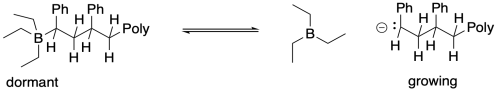
Una estrategia alternativa para la polimerización aniónica viva implica la adición de compuestos ácidos de Lewis como agentes de control de cadena. En estos casos, el equilibrio entre cadenas latentes y en crecimiento implicaría la coordinación del extremo de la cadena aniónica con el átomo ácido de Lewis. Debido a que los complejos ácido-base de Lewis ocurren en equilibrio, alguna fracción de los polímeros siempre existiría en la fase de crecimiento, pero siempre se encontraría una fracción mayor en la fase latente.
Ejercicio 2.7.1
Clasificar los siguientes iones en términos de covalencia con oxígeno (más covalente a menos covalente).
- Na +, Li +, K +
- Mg 2+, Ca 2+, Ser 2+
Ejercicio 2.7.2
El número de coordinación puede variar con el tamaño de un catión. Clasifica los siguientes iones de mayor a menor.
- Na +, Li +, K +
- Mg 2+, Ca 2+, Ser 2+
Ejercicio 2.7.3
¿Qué compuestos se esperaría que estabilizaran las cadenas aniónicas en crecimiento?
- Et 3 N o Et 3 Al
- Et 2 Zn o Et 2 O
- Ph 3 B o Ph 3 N
- (CH 3 O) 2 ALCH 3 o (CH 3 O) 2 CHCH 3

