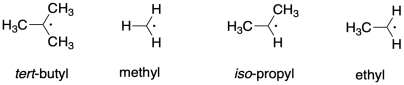2.9: Polimerización radical
- Page ID
- 71986
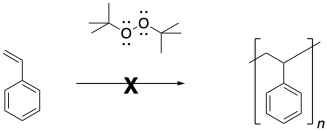
La polimerización por radicales es un enfoque muy común para la fabricación de polímeros. Hay una serie de métodos muy confiables para llevar a cabo la polimerización radical, que conducen a materiales de alto peso molecular. Un ejemplo típico es la formación de poliestireno bajo la influencia del iniciador radical, azoisobutironitrilo (AIBN).
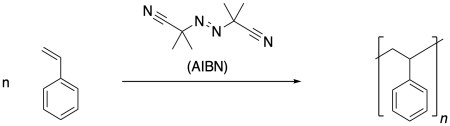
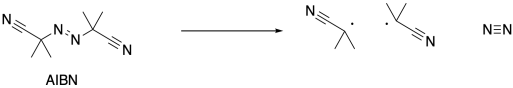
Las reacciones radicales comienzan con una reacción de iniciación, en la que primero aparecen los radicales. Cuando se usa AIBN como iniciador, el compuesto se descompone en parte debido al fuerte triple enlace N-N que se forma, y en parte por el radical relativamente estable que resulta. Este radical es tanto terciario como deslocalizado.
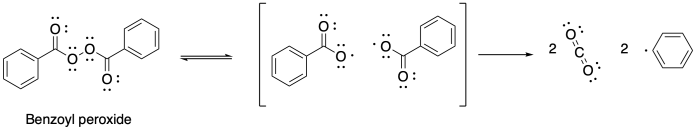
También se pueden usar otros iniciadores en polimerizaciones por radicales. El peróxido de benzoilo (BPO) es un ejemplo común. En este caso, la reacción de iniciación es desencadenada por el débil enlace sencillo O-O. El radical benzoato que se forma a partir de esa homólisis se descompone aún más a través de la descarboxilación, dando lugar rápidamente a un radical fenilo.
Los radicales fenilo y los radicales isobutironitrilo son capaces de iniciar la polimerización del estireno. No cualquier radical hará esa tarea. Los peróxidos simples no son muy buenos para iniciar la polimerización radical, a pesar de que también contienen enlaces O-O que se escinden fácilmente.

Los radicales centrados en oxígeno normalmente no se agregan a los dobles enlaces. Es mucho más común verlas abstractas de átomos de hidrógeno. Por consiguiente, los peróxidos de terc-butilo y otros peróxidos similares no se usarían para iniciar la polimerización del estireno.
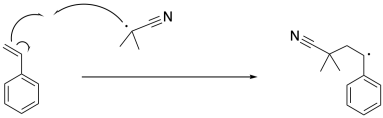
El radical formado a través de la iniciación induce la escisión del enlace pi en estireno, dando como resultado un radical bencílico. Este es un ejemplo de un paso de propagación, porque los radicales viejos han desaparecido y han aparecido nuevos radicales.
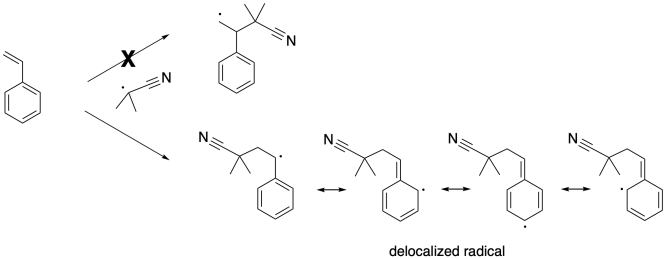
Tenga en cuenta que este paso se lleva a cabo con regioselectividad. Hay dos posibles radicales que podrían resultar, pero en realidad solo se forma uno. Esa es la más estable. Se estabiliza por deslocalización debido al anillo de benceno.
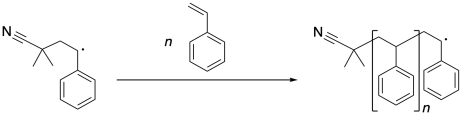
Una vez que ese radical bencílico se forma, puede continuar propagándose, cautivando a más moléculas de estireno. Cada vez que se encadena una nueva molécula de estireno, forma un nuevo radical bencílico.
Eventualmente, las reacciones radicales sufren terminación, en la que dos radicales se combinan de alguna manera para que ninguno sea ya radical. La forma más obvia de que eso suceda es si dos cadenas de cultivo se encuentran cabeza a cabeza, con dos radicales bencílicos que se conectan para formar un enlace.
Otros eventos de terminación también son prevalentes en las polimerizaciones por radicales. La abstracción de átomos de hidrógeno es bastante común, con un radical creciente robando un átomo de hidrógeno alfa a la radilca a la cabeza de otra cadena. La razón que puede suceder es que da como resultado la formación de dos nuevos enlaces: un enlace C-H y un enlace C-C pi. En ese caso, ambas cadenas dejan de crecer. El que contiene el nuevo bono pi podría eventualmente reiniciarse, claro, pero mientras tanto se quedará atrás de la mayoría de las otras cadenas que seguirán creciendo sin él. Ese rezago conducirá a una distribución del peso molecular cada vez mayor.
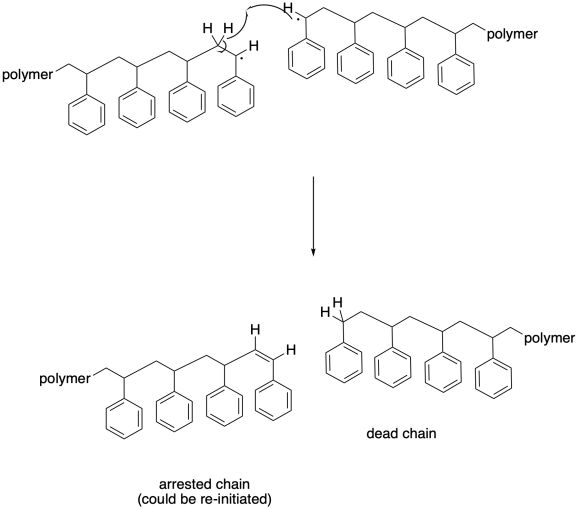
En parte debido al inmenso tamaño de las moléculas involucradas, la abstracción del átomo de hidrógeno necesariamente tiene que tener lugar alfa a otro radical. Una cadena en crecimiento puede pasar a otra de tal manera que su radical bencílico roza un átomo de hidrógeno a lo largo de la cadena principal de otra. La abstracción de átomos de hidrógeno puede ocurrir de forma más aleatoria en este caso, aunque aún puede resultar en un nuevo radical bencílico.
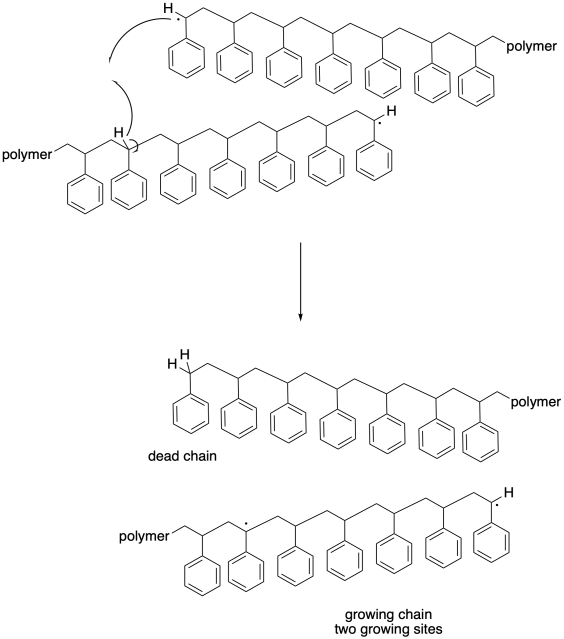
En este caso, una cadena se vuelve muerta; deja de crecer por completo, al igual que una de las cadenas en el caso anterior. Sin embargo, la otra cadena sigue creciendo. De hecho, con dos sitios radicales, comenzará a crecer dos veces más rápido que el resto de las cadenas de cultivo. Una vez más, este desarrollo conduce a una ampliación dramática de la distribución del peso molecular. Además, este evento “mordiendo” conduce a un cambio en la morfología de la cadena en crecimiento. Debido a que ahora está creciendo a partir de dos sitios diferentes, esta cadena se ramifica, a diferencia de todas las otras cadenas que están creciendo de manera lineal. No solo tenemos cadenas de longitudes muy diferentes, sino que también tenemos cadenas de formas muy diferentes, y sus propiedades están cada vez menos definidas.
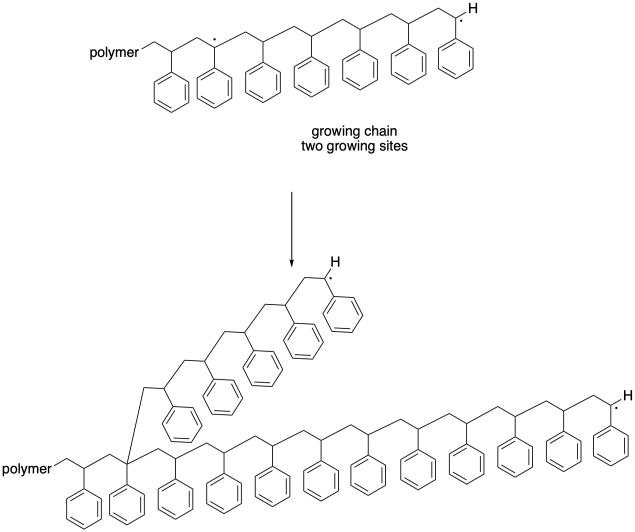
Estos pasos de terminación son importantes porque resultan en la muerte de las cadenas en crecimiento y por lo tanto tienen un impacto en los polímeros que resultan. En secciones posteriores, veremos algunas estrategias que limitan estos pasos de terminación, dando lugar a una distribución más uniforme del peso molecular y propiedades poliméricas más confiables.
Hasta el momento, nos hemos centrado en el poliestireno como ejemplo de polimerización radical, debido a la obvia estabilidad del radical bencílico. Otros monómeros también se pueden polimerizar en condiciones similares. Al igual que el estireno, pueden dar lugar a radicales deslocalizados por resonancia. En otros casos, la estabilidad radical puede ser menos obvia, como en el caso del cloruro de vinilo. El cloruro de vinilo (CH 2 =CHCl) es un candidato bastante para la polimerización radical porque los radicales son estabilizados por átomos de halógeno adyacentes.
Eso puede venir como una sorpresa. Esta estabilidad resulta de un efecto de hiperconjugación, en el que el solapamiento entre el electrón radical y un par no enlazante sobre el halógeno da como resultado una estabilización neta. Esta idea es similar a la que hay detrás de la estabilidad de los radicales altamente sustituidos, como los radicales en los carbonos terciarios.

Problema SM7.1.
Mostrar los polímeros que resultarían de la polimerización radical de los siguientes monómeros.
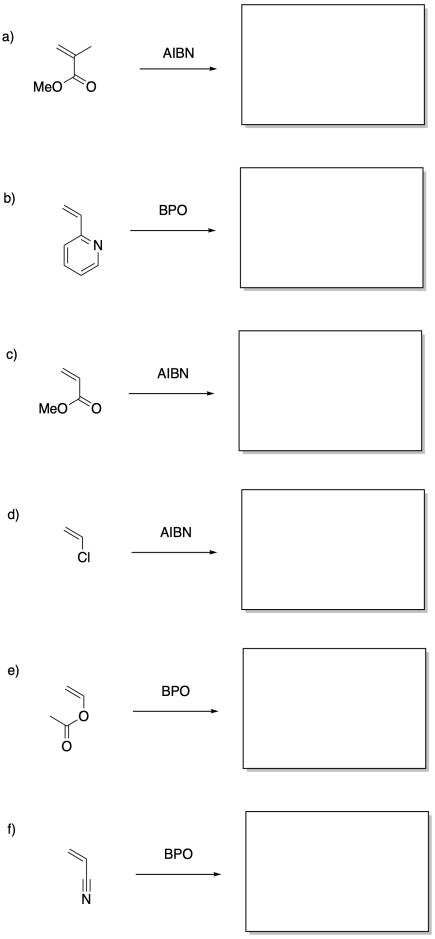
Problema SM7.2.
Mostrar por qué los radicales formados a partir de los siguientes monómeros son relativamente estables:
a) acrilonitrilo, CH 2 =CHCN
b) acrilato de metilo, CH 2 =CHCO 2 Me
Problema SM7.3.
Además de la deslocalización de resonancia, el grado de sustitución también es un factor estabilizador modesto para los radicales. Indicar el orden de estabilidad de los siguientes radicales: