4.4: Transición vítrea
- Page ID
- 71985
La transición vítrea es probablemente la característica más comúnmente citada de un material polimérico. A la temperatura de transición vítrea, la naturaleza física del material cambia sutilmente. Pasa de ser un material cauchoso y flexible a mayor temperatura, por encima de la transición vítrea, a un material vítreo y más duro a menor temperatura. El material sigue siendo un sólido de cualquier manera, pero hay un cambio definitivo en la forma en que responde a los estímulos.
Un material ciertamente podría ser útil en cualquiera de los dos estados. Podríamos querer que un plástico sea más rígido, como una botella de agua o una barra para una cortina de ducha. Alternativamente, podríamos querer que sea más suave, como un cojín de asiento. De cualquier manera, podría ser útil conocer la temperatura a la que el material cambiará de un tipo a otro.
La transición vítrea es un poco como lo que sucede con los ositos de goma cuando los pones en helado. Directamente de la bolsa, los ositos de goma son masticables, pero no sienten que te romperán los dientes. Ponlos en helado y eso cambia. Se vuelven mucho más difíciles de masticar.
La explicación clásica de la transición vítrea se basa en la idea de flujo en cadena. Los polímeros son moléculas de cadena larga y, dada un poco de energía, las cadenas se mueven alrededor. Se menean. Se someten a rotaciones de enlace, cambiando de una conformación a otra. Un bloque de material contiene montones de cadenas, como un nido de serpientes. Los extremos de la cadena y los bucles se revuelven uno junto al otro continuamente.
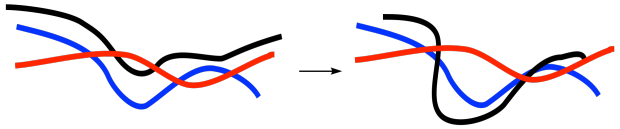
El flujo en cadena permite que un material se adapte cuando se ejercen fuerzas sobre él. Podemos doblar una goma de borrar porque las cadenas en la goma se deslizan unas sobre otras y adoptan una nueva forma. Al menos, eso es lo que sucede a temperatura ambiente. Puede que no funcione si la goma de borrar se dejara caer accidentalmente en algo de nitrógeno líquido, que es muy, muy frío.
A medida que un bloque de material se enfría, se contrae. Las moléculas se empaquetan más estrechamente juntas. En algún momento, el volumen libre —esa es la cantidad de volumen en el material que en realidad no es absorbidas por las moléculas— se vuelve demasiado pequeño para permitir que las cadenas se muevan entre sí. Todas esas cadenas necesitan un poco de espacio a su alrededor si van a sufrir cambios conformacionales, y los cambios conformacionales son cómo se mueven las cadenas de polímeros. Sin ese espacio extra, el material de repente se vuelve menos flexible.
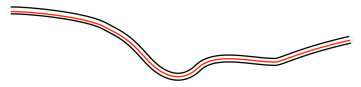
Si empezamos en el estado vítreo y aumentamos la temperatura, el volumen del material se está expandiendo, y el volumen libre también aumenta. En algún momento, el volumen libre se vuelve lo suficientemente grande como para que las cadenas puedan deslizarse entre sí. El material se vuelve más flexible. Se vuelve gomoso.
Ahora bien, esta transición no es lo mismo que fundirse. Las cadenas no están superando completamente sus interacciones entre sí y ganando libertad de movimiento en cualquier dirección. Las cadenas siguen muy enredadas. Porciones de la cadena se deslizan una junto a la otra, pero en general las cosas no han cambiado tan drásticamente. El bloque de polímero no se convierte en un charco gooey de líquido.
Bueno, si un material puede cambiar de vítreo a gomoso a cierta temperatura, habrá consecuencias en cómo se comporta el material. Por ejemplo, las llantas de tu auto están pensadas para ser gomosas y flexibles; ese factor les ayuda a agarrar la carretera. Si el clima hace demasiado frío y tus llantas se vuelven vidriosas, las llantas ya no tienen la misma flexibilidad y no tienes tanta tracción. Las “llantas para todo clima” están compuestas por una goma que tiene una temperatura de transición vítrea muy baja, ayudando a evitar este problema. (Las “llantas de nieve” son una cosa diferente; tienen patrones en las bandas de rodamiento que ayudan a canalizar la nieve para mejorar la tracción). Saber cuándo ocurrirá este cambio sería muy útil. Entonces, ¿cómo determinamos la transición vítrea?
Los cambios de fase, como los puntos de fusión, se miden mediante calorimetría, así que comencemos ahí. Cuando se calienta un sólido, su temperatura aumenta. Eso parece bastante sencillo. La temperatura es básicamente una medida del contenido de calor, por lo que a medida que el calor fluye, la temperatura medida aumenta. Esta sencilla relación se rompe en el punto de fusión. En ese punto, el calor que fluye hacia el material es consumido por la ruptura de las fuerzas intermoleculares. Superar estas atracciones cuesta energía extra. En consecuencia, hay un punto en el que el aumento de temperatura en el material se detiene temporalmente mientras se funde.
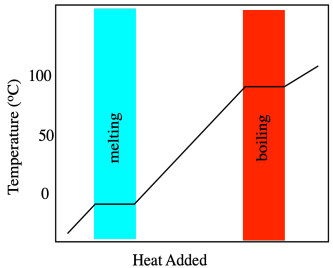
Este calor extra necesario para fundir el material se llama calor de fusión o, más comúnmente, calor de fusión. El calor de fusión en realidad se refiere al proceso opuesto ya que el material se enfría y se congela. A medida que el calor se aleja de un material de enfriamiento, se enfría gradualmente, pero llega un punto en el que se forman esas fuertes interacciones intermoleculares, desprendiendo algo de calor extra. La temperatura de fusión es la misma que la temperatura de fusión, y el calor de fusión es el mismo que el calor de fusión, pero en un caso se agrega el calor y en otro caso se desprende el calor. En principio, si solo calentamos algo y buscamos ese punto de estancamiento en la temperatura, podemos encontrar la temperatura de la transición de fase.
Calorimetría diferencial de barrido
La calorimetría diferencial de barrido (DSC) es una técnica que se usa comúnmente para medir las transiciones de fase, incluyendo la temperatura de transición vítrea. Se basa en las mismas ideas pero el experimento se ejecuta de una manera ligeramente diferente. En DSC, tenemos dos pequeñas cámaras de muestra una al lado de la otra. Uno contiene el material que nos interesa y el otro (vacío) se utiliza como referencia. El instrumento calienta ambas muestras a una velocidad constante, manteniendo ambas a la misma temperatura. En consecuencia, en realidad puede agregar más calor a una cámara que a la otra, de manera que ambas alcancen 30.5 °C al mismo tiempo, luego 30.6 °C, y así sucesivamente. Una vez que alcanzamos el punto de fusión de la muestra de interés, se debe incrementar el flujo de calor hacia esa muestra para que pueda mantenerse al día con la referencia. Pasado ese punto, el flujo de calor vuelve a caer a un nivel más normal.
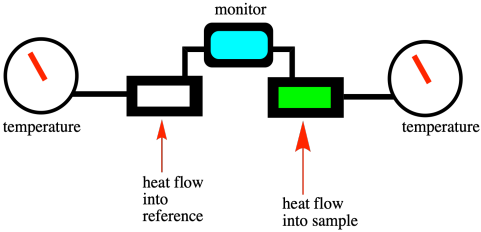
Si observamos un escaneo DSC, vemos un gráfico del flujo de calor en el eje y y la temperatura en el eje x. El flujo de calor generalmente se mantiene bastante constante a medida que aumenta la temperatura. En el punto de fusión, el flujo de calor aumenta, pero luego vuelve a bajar una vez que se ha superado el punto de fusión. No puede volver a caer al mismo nivel que antes, sin embargo, debido a que el flujo de calor que se registra está relacionado con la capacidad calorífica del material. El sólido y el líquido suelen responder de manera diferente al calor. En general, debido a que las moléculas en un líquido pueden rotar libremente, tienen algo más que ver con el calor agregado. Por lo tanto, los líquidos tienen una capacidad calorífica ligeramente mayor que sus sólidos correspondientes.
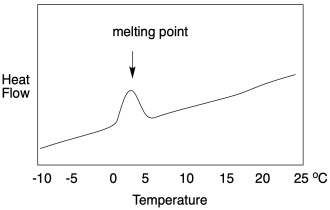
Toda esa explicación ojalá nos prepare para un estudio DSC de la temperatura de transición vítrea. Funciona de la misma manera, pero sólo hasta cierto punto. Si miramos un escaneo DSC, aún vemos flujo de calor en el eje y y temperatura en el eje x. En la transición vítrea, el flujo de calor aumenta ligeramente, y permanece ahí. Se ve muy diferente a un punto de fusión. Un barrido DSC de un punto de fusión muestra un “pico” a la temperatura de transición. Un escaneo DSC de un punto de transición vítrea muestra solo un pequeño paso, como una orilla del río
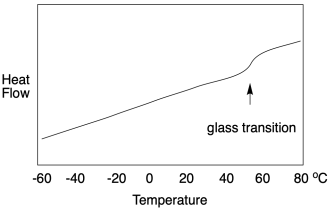
¿Por qué es diferente? Bueno, la transición vítrea no es realmente un cambio de fase como el punto de fusión o punto de ebullición. No implica un cambio físico de estado. Era un sólido antes y es un sólido después. No se deben superar de repente interacciones intermoleculares para liberar las moléculas entre sí. En cambio, es solo un cambio de volumen. El volumen libre se hizo lo suficientemente grande como para que las cadenas puedan deslizarse unas junto a otras, pero las cadenas siguen aferrándose en estado sólido. Ahora bien, ese movimiento adicional sí tiene consecuencias. El material se vuelve más flexible. Si el calor fluye, hay más libertad de movimiento en la que se puede distribuir el calor. Es decir, hay un ligero incremento en la capacidad calorífica, y eso es lo que observamos en DSC.
Una nota práctica: los escaneos DSC en realidad se pueden mostrar de dos maneras diferentes. El eje y puede mostrar el calor que fluye hacia adentro o el calor que fluye hacia afuera. Eso significa que los puntos de fusión pueden parecerse a picos o valles, dependiendo de cómo se muestren los datos. A menudo, los datos están etiquetados con una flecha que dice “endo” para indicarle qué dirección a lo largo del eje y significa que fluye más calor (o posiblemente “exo”, es decir, qué dirección significa que el calor fluye hacia afuera). Hay que mirar cuidadosamente si las cosas parecen atrasadas.
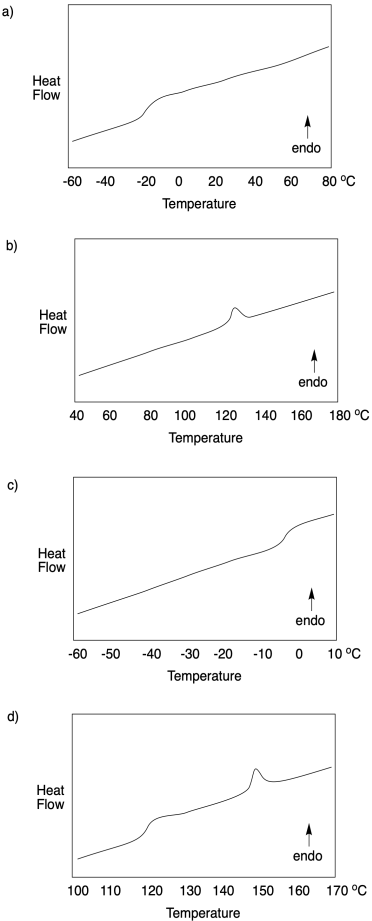
Problema CP4.1.
Para cada traza de DSC, indica qué tipo de transición está ocurriendo a qué temperatura.
¿Por qué la temperatura de transición vítrea varía de un tipo de polímero a otro? ¿Qué factores estructurales influyen en la temperatura de transición vítrea? Esta relación estructura-propiedad no es sencilla, ya que parece haber una serie de variables diferentes involucradas. Sin embargo, el más simple de estos factores es solo el peso molecular. Cuanto mayor sea el peso molecular de un polímero, mayor será su temperatura de transición vítrea. Esta relación es cierta sólo hasta cierto punto, sin embargo. La dependencia no lineal de la temperatura de transición vítrea del peso molecular se describe mediante la ecuación de Flory-Fox:
\[T_g = T_{g(∞)} - \dfrac{K}{ M_n}\]
Aquí, T g (∞) se refiere a la temperatura de transición vítrea de una cadena infinitamente larga del polímero. K es una constante para un polímero en particular, como poliestireno o polietileno.
Una gráfica de T g vs M n se asemeja a una curva de saturación; la línea se eleva bruscamente, estancándose gradualmente y continuando paralela al eje x. En otras palabras, aunque esta relación de aumento de la temperatura de transición vítrea con el aumento del peso molecular se mantiene cierta a pesos moleculares relativamente bajos, la temperatura de transición vítrea permanece constante una vez que se ha alcanzado un peso molecular umbral.

