1.17: Carbohidratos- Monosacáridos
- Page ID
- 74242
Mono-, Di- y Polisacáridos
Los azúcares son pequeñas moléculas que pertenecen a la clase de carbohidratos. Como su nombre lo indica, un carbohidrato es una molécula cuya fórmula molecular puede expresarse en términos de solo carbono y agua. Por ejemplo, la glucosa tiene la fórmula C 6 (H 2 O) 6 y la sacarosa (azúcar de mesa) tiene la fórmula C 6 (H 2 O) 11. Los carbohidratos más complejos como el almidón y la celulosa son polímeros de glucosa. Sus fórmulas pueden expresarse como C n (H 2 O) n-1. Los veremos con más detalle la próxima vez.
La diferencia entre un monosacárido y un disacárido se puede observar en el siguiente ejemplo:
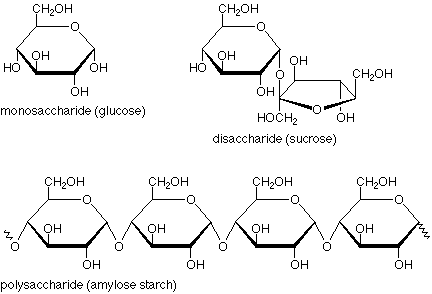
Una mirada rápida nos dice que un monosacárido tiene solo un anillo, un disacárido tiene dos, y un polisacárido tiene muchos. Más allá de eso, sin embargo, hay otra característica estructural importante. Mire el disacárido y concéntrese en el oxígeno que une los dos anillos entre sí. El átomo por encima de él está conectado a dos oxígenos, ambos de los cuales se encuentran en situaciones de tipo éter. El carbono y estos oxígenos están en un enlace acetal. (Los bonos son más pesados y en azul.)
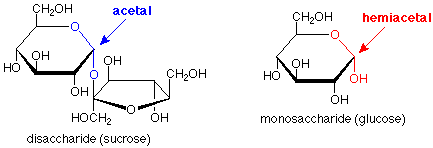
Si observamos la ubicación correspondiente en el monosacárido y preguntamos cuál podría ser el grupo funcional, vemos que se trata de un hemiacetal. (Aquí los bonos son más pesados y en rojo.) Entonces, otra forma de describir la situación es que un monosacárido tiene un solo anillo con un hemiacetal en él, un disacárido tiene dos anillos unidos por un grupo funcional acetal, y un polisacárido tiene muchos anillos unidos por muchos grupos funcionales acetales. (Verifique esta última declaración contra la estructura de polisacáridos anterior).
¿Qué tal los “azúcares” que vimos la última vez con solo 4 carbonos? ¿Por qué son monosacáridos cuando no hay anillo? Si consideramos que el grupo OH en el carbono inferior podría formar un hemiacetal con la función aldehído, entonces obtenemos un anillo, y esa estructura se ajusta a nuestra descripción de un monosacárido.
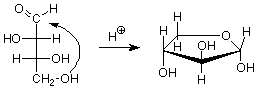
Vamos a echar un vistazo más detallado a las estructuras cíclicas y no cíclicas de los azúcares en breve.
“Oses” y D-Azúcares
Ahora veamos qué significa aldotetrose. Tomando el nombre aparte de derecha a izquierda, el final “ose” significa un azúcar, que puede ser un monosacárido, un disacárido o un oligosacárido (un polisacárido “corto”). La parte media “tetr” significa que nuestro azúcar tiene cuatro carbonos unidos en una cadena lineal no ramificada. Términos como “pent” para cinco carbonos y “hex” para seis carbonos también son de uso común. El principio “aldo” significa que hay un aldehído en el compuesto. La alternativa sería un grupo cetona, para lo cual usaríamos el prefijo “keto”.
La glucosa, el monosacárido más común, es una aldohexosa. Entendemos que significa que es un azúcar que tiene seis carbonos en una cadena lineal no ramificada que termina en un grupo aldehído. Podemos representar esa estructura de esta manera:
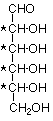
Esta estructura incluye cuatro átomos de carbono estereogénicos (marcados con un asterisco *). Hay un total de dieciséis estereoisómeros posibles. Ocho de estos son enantiómeros de los otros ocho. El resto de las relaciones son diastereoisoméricas. Dado que los grupos en la parte superior e inferior de la cadena no son los mismos, no hay isómeros meso. Ocho de los isómeros se muestran aquí. Los otros ocho son imágenes especulares de estos y pueden ser dibujados fácilmente.
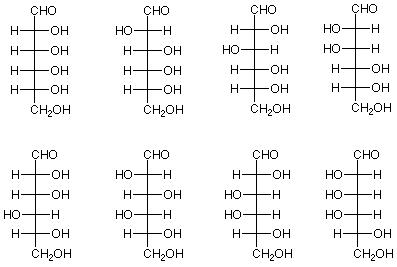
La pregunta es “¿cuál de las dieciséis representaciones estereoquímicas (proyecciones Fischer, recuerden que cada estereoisómero mostrado también tiene un enantiómero que no se muestra) describe la configuración absoluta de la glucosa? Cuando Emil Fischer retomó este problema hace unos 100 años, se dio cuenta de que no había forma de determinar si la glucosa era una de las ocho estructuras anteriores o uno de los enantiómeros no mostrados. Hizo la suposición de que era uno de los anteriores para que pudiera trabajar en la parte diastereoisomérica del problema, esperando que un trabajo posterior resolviera la cuestión de qué enantiómero representaba mejor la glucosa.
Fischer también desarrolló el sistema D/L para especificar las estructuras de los azúcares. Si el grupo OH en el carbono estereogénico más alejado del grupo aldehído está a la derecha en la proyección de Fischer, entonces el compuesto es un D-azúcar. Todos los azúcares de la figura anterior son D-azúcares. Si el grupo OH en el carbono estereogénico más alejado del grupo aldehído está a la izquierda en la proyección Fischer, entonces el compuesto es un azúcar L. Los enantiómeros de todos los azúcares en la figura anterior son azúcares L. La suposición de Fischer equivale a decir que la glucosa es un D-azúcar. Posteriormente el trabajo resolvió este tema, y Fischer tenía razón.
¿Qué D-aldohexosa es glucosa?
¿Cómo determinó Fischer cuál de las ocho estructuras anteriores era glucosa? Tenía disponibles muestras de glucosa y manosa, ambas aldohexosas, y arabinosa, una aldopentosa. También aprendió a reducir el grupo funcional aldehído a un alcohol primario. (Ilustraremos esto con NaBH 4 para evitar aprender una nueva reacción, pero usó otro reactivo). Desarrolló un método para extender la cadena de carbono de una aldosa (llamada extensión de cadena Kiliani-Fischer). También tenía un polarímetro para poder determinar si una muestra era ópticamente activa o no. Quizás lo más importante, tenía un grupo de estudiantes talentosos y dedicados.
- Ahora, algunos datos.
- Resultado experimental: Cuando el grupo aldehído de la arabinosa se redujo a un grupo alcohol primario, el producto fue ópticamente activo.
- Conclusión: La arabinosa tiene la estructura 2 o 4 en el siguiente esquema. Esto se debe a que si la arabinosa fuera 1 o 3, el producto tendría un plano de simetría (plano espejo) y estaría ópticamente inactivo.
-
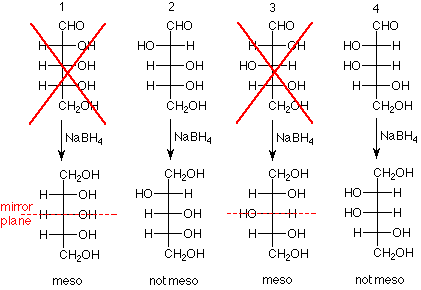
- Resultado experimental: Cuando el grupo aldehído de la glucosa se redujo a un grupo alcohol primario, el producto fue ópticamente activo. El mismo resultado se obtuvo para la manosa.
- Conclusión: Las estructuras “X'd” a continuación no representan ni glucosa ni manosa ya que los productos de estas estructuras serían compuestos meso.
-
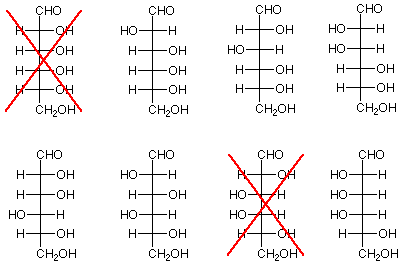
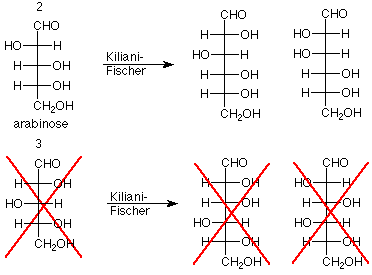
- Resultado experimental: La extensión de la cadena Kiliani-Fischer aplicada a arabinosa produce glucosa y manosa.
- Conclusión: Los tres átomos de carbono estereogénicos inferiores de glucosa y manosa tienen configuraciones idénticas a los tres átomos de carbono estereogénicos de arabinosa. Esto significa que la glucosa y la manosa difieren solo en la configuración del átomo de carbono estereogénico más cercano al grupo funcional aldehído. Podemos concluir además que si se descarta un miembro de un par de aldohexosas (emparejadas porque sus tres carbonos estereogénicos inferiores son idénticos), también lo es el otro
-
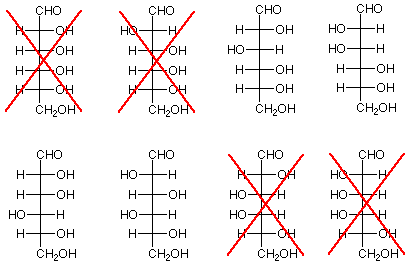
Ahora veamos qué nos queda. Quedan cuatro estructuras como candidatos. Están a la derecha abajo. Si volvemos a las posibilidades de arabinosa, encontramos que los dos en la parte superior provienen de la estructura 2 para arabinosa, lo que era una posibilidad, mientras que los dos en la parte inferior provienen de la estructura 3, que se descartó antes. La conclusión es que la arabinosa está representada por la estructura 2, y la glucosa y la manosa son las dos estructuras a su derecha.
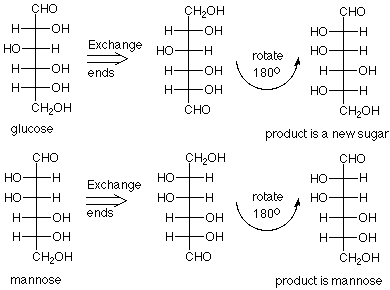
Pero, ¿cuál es la glucosa y cuál es la manosa? Fischer notó que si se pudieran desarrollar reacciones que cambiaran el grupo aldehído en un alcohol primario y el alcohol primario en un aldehído (extremos de cambio) una de estas estructuras se daría a sí misma, y la otra devolvería un nuevo azúcar L. Las reacciones son complejas y no las veremos, pero cuando se aplicó la química a la muestra llamada manosa, el producto fue manosa. Cuando se aplicó la química a la muestra llamada glucosa, se formó un nuevo azúcar.
Quedaba mucho más por hacer para confirmar esta conclusión y sintetizar las otras seis aldohexosas, pero el ejercicio de lógica y experimentación dedicada de Fischer llevaron a concluir que las ocho D-aldohexosas son:
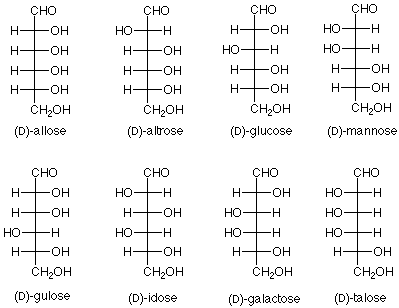
Observe que el nuevo azúcar que se produjo a partir de glucosa por el experimento de “extremos de intercambio” es L-gulosa. Los nombres de las hexosas nos indican qué diastereoisómero tenemos; la designación D o L nos da qué enantiómero tenemos.
Los nombres correspondientes para las aldopentosas son:
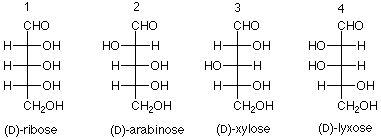
Estructuras Cíclicas - Anómeros
Para terminar hoy, veremos qué sucede cuando se forma un hemiacetal entre el carbono aldehído y uno de los grupos OH en la cadena. Veremos dos ejemplos, la ribosa, que es un componente clave del ARN, y la glucosa por su abundancia. (Es posible que desee revisar el mecanismo para la formación de hemiacetales.)
Dado que hay cuatro grupos OH en la ribosa, podríamos anticipar cuatro tamaños de anillo diferentes. En los anillos de tres átomos y los anillos de cuatro átomos los ángulos de enlace están lejos de 109.5 o, por lo que estos anillos están tensos, tienen energías más altas y son difíciles de formar. Recuerde que existe un equilibrio entre un hemiacetal y el aldehído/alcohol del que proviene, y que los materiales de alta energía no persisten en equilibrio. Nos quedan anillos que tienen cinco o seis átomos en ellos. En el caso de la ribosa el anillo importante (que se encuentra en el ARN) es el anillo de cinco miembros.
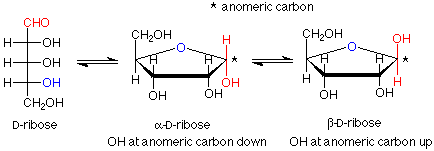
Observe que el carbono en el grupo hemiacetal recién formado es estereogénico. Esto significa que existen dos posibles diastereoisómeros para la estructura cíclica. Por lo general, ambos se forman, y tienen un nombre especial —son anómeros el uno del otro. El carbono entre los dos oxígenos en el grupo hemiacetal se denomina carbono anomérico. Si el grupo OH está abajo (en un dibujo con el anillo de oxígeno al centro trasero o a la derecha), la designación para ese anómero es alfa. Si el grupo OH está arriba, la designación es beta. Dado que los anómeros alfa y beta son diastereoisómeros, tienen diferentes propiedades; en particular, diferentes actividades ópticas. El término para un anillo de azúcar de cinco átomos es “furanosa”.
La glucosa generalmente produce estructuras cíclicas hemiacetales con anillos de seis átomos, aunque también se pueden formar anillos de cinco miembros cuando se descartan los anillos de seis miembros. Dichos anillos de seis miembros son nombrados por el término “piranosa”. Las formas de anillo se ven así, teniendo en cuenta que los anómeros alfa y beta también están involucrados aquí:
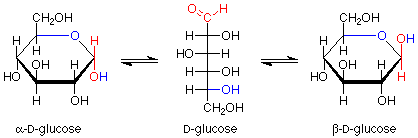
Nuevamente, tenemos un equilibrio entre la forma de cadena abierta y los dos anómeros diastereoisoméricos.
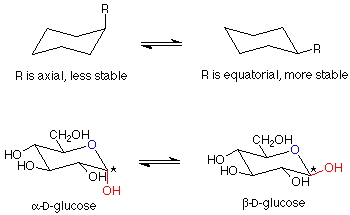
Hay un punto más que hacer sobre estas glucopiranosas. La estructura que hemos dibujado para el anillo es plana. Los ángulos de unión serían de 120 o, bastante lejos del valor tetraédrico normal de 109.5 o. Los átomos en el anillo pueden tener ángulos de enlace de aproximadamente 109.5 o si el anillo se frunce como se muestra aquí:
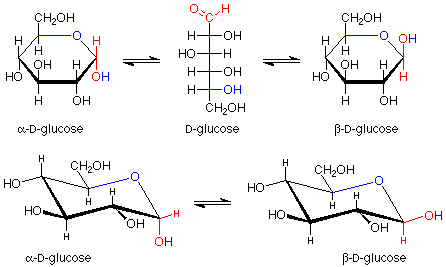
Por supuesto, las moléculas adoptan automáticamente estas formas arrugada (llamadas conformaciones de sillas por su parecido a un sillón bastante ancho). Se puede revisar el material sobre ciclohexano para un análisis más detallado de este material. Se ha establecido que en estas conformaciones silla, las moléculas tienen una energía menor si los sustituyentes más grandes en los carbonos están aproximadamente en el plano del anillo mismo. Estas posiciones se denominan “ecuatoriales” para distinguirlas de las otras posiciones (aproximadamente perpendiculares al anillo, llamadas “axiales”). Un compuesto que puede tener todos sus sustituyentes más grandes (todo es más grande que el hidrógeno) en una posición ecuatorial es más estable que uno que no puede. La beta-D-glucosa tiene todos sus sustituyentes en posiciones ecuatoriales, y por lo tanto es la hexopiranosa más estable. También es el más abundante.