1.18: Glucósidos, Disacáridos, Polisacáridos
- Page ID
- 74306
Glucósidos
La última vez exploramos las características estructurales de los monosacáridos. Vimos que las principales características estereoquímicas de las aldohexosas y aldopentosas son útilmente descritas por las fórmulas de proyección de Fischer, pero aprendimos que las estructuras de estos compuestos también deben entenderse como hemiacetales cíclicos. Hoy veremos con más detalle la química de ese enlace hemiacetal. En particular, recordaremos cómo los hemiacetales se convierten en acetales. Encontraremos que estos enlaces acetales son lo que mantiene unidos a los di- y polisacáridos.
Comencemos recordando la secuencia de reacción que une aldehídos y alcoholes, hemiacetales y acetales.
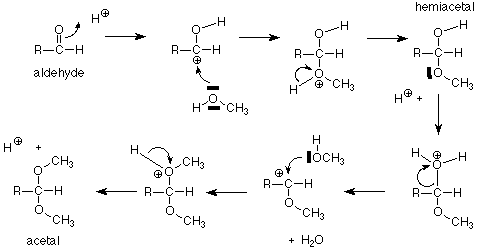
Para nuestros propósitos, la característica clave es la conversión de un hemiacetal y un alcohol a un acetal, con la liberación concurrente de una molécula de agua. Si aplicamos esta característica del esquema a una solución de glucosa en metanol (con un rastro de catalizador ácido incluido), obtenemos:
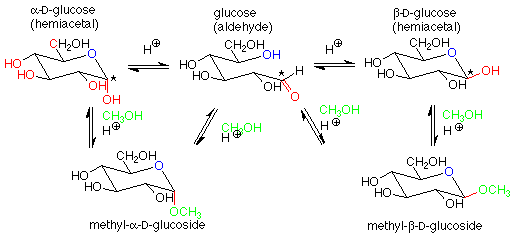
Los productos acetales se llaman “glucósidos”. Si el azúcar que se usa es glucosa, son “glucósidos”. Existen varios mecanismos razonables para estas conversiones y no los veremos en detalle. Ten en cuenta que la conversión entre un hemiacetal y un acetal requiere de un catalizador ácido. La conversión entre un aldehído y un hemiacetal es catalizada ya sea por base o por ácido. Las condiciones se pueden organizar para producir la estereoquímica alfa o beta en el glucósido.
Los glucósidos son muy comunes en la naturaleza. Además de los di- y polisacáridos que veremos más adelante, es muy común que la glucosa (u otros azúcares) y un alcohol formen un enlace acetal. A menudo esto mejora la solubilidad en agua del alcohol y facilita la excreción. Este es el caso del colesterol:
Azúcares reductores y no reductores
Existe otra diferencia importante entre los enlaces hemiacetal y acetal en azúcares y sacáridos, y esa es su reacción con agentes oxidantes suaves. Los aldehídos son bastante fáciles de oxidar a ácidos carboxílicos, mientras que los acetales (que no tienen grupo carbonilo) son bastante difíciles de oxidar. Los agentes oxidantes utilizados en la química de carbohidratos son típicamente compuestos de cobre (II) que se reducen a óxido de cobre (I). Los azúcares que son oxidados por estos reactivos se denominan azúcares reductores porque reducen el cobre (II) a cobre (I).
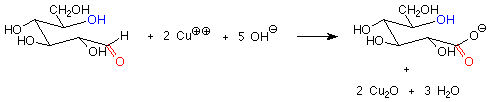
Estos reactivos se utilizan en solución básica, de manera que los hemiacetales y aldehídos están en equilibrio. Esto significa que la forma hemiacetal cíclica de un azúcar producirá una cantidad de equilibrio de la forma aldehído de cadena abierta, que luego reducirá el cobre (II) a cobre (I) y dará una prueba positiva. Una forma hemiacetal es así un azúcar reductor.
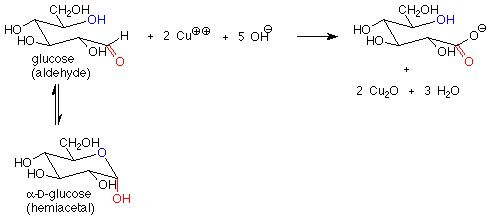
En contraste, las formas acetales (glucósidos) no son azúcares reductores, ya que con base presente, el enlace acetal es estable y no se convierte en aldehído o hemiacetal. El resultado es que en un azúcar reductor el carbono anomérico se encuentra en un aldehído o hemiacetal. En un azúcar no reductor, el carbono anomérico se encuentra en un acetal.
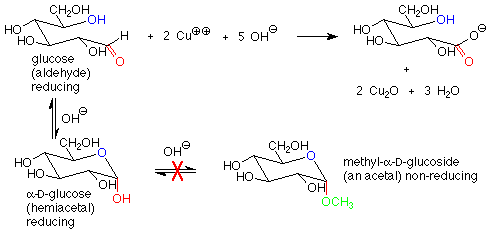
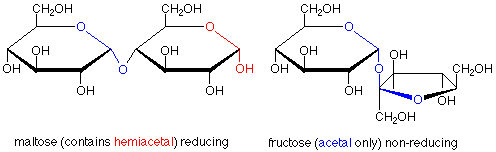
La caracterización de azúcares como reductores o no reductores da pistas útiles en cuanto a sus estructuras. Considere los disacáridos maltosa y fructosa. La maltosa contiene un grupo funcional hemiacetal y es un azúcar reductor. En la fructosa, ambos carbonos anoméricos están en grupos funcionales acetales, por lo que la fructosa es un azúcar no reductor.
Disacáridos
Esto nos lleva al tema de los disacáridos. Los enlaces entre las unidades de anillo monosacárido en los disacáridos son enlaces acetales. Podemos concebirlos como hechos por la formación de un acetal a partir de un hemiacetal y un alcohol. Para ello, el hemiacetal incluye el carbono anomérico de un monosacárido y el papel alcohólico lo juega un grupo OH específico de un segundo monosacárido. La formación de maltosa a partir de dos moléculas de glucosa es un ejemplo de esto:
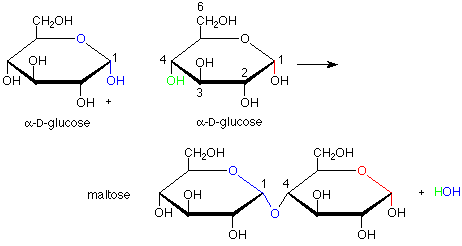
Hay varias características intrigantes de esta conversión. En primer lugar, es catalizada por la enzima maltasa. El término “catalizado” implica que la enzima acelera la reacción en ambas direcciones, de manera que tanto la formación como la hidrólisis (conversión de acetal a hemiacetal usando una molécula de agua) son más rápidas con la enzima. La catálisis enzimática suele ser también muy específica. En este caso, esa especificidad se manifiesta en el hecho de que el nuevo enlace acetal tiene la configuración alfa, no la beta (y correspondientemente, la maltasa cataliza la hidrólisis de un enlace alfa pero no le hace nada al enlace beta). Además, solo el grupo OH en el átomo de carbono número cuatro se usa como el alcohol cuando podrían haberse utilizado otros, como los de los carbonos 1, 2, 3 y 6. Esto sugiere que la enzima mantiene las dos moléculas de glucosa en posiciones específicas para que solo el OH en el carbono 4 de una glucosa pueda alcanzar el carbono anomérico de la otra glucosa.
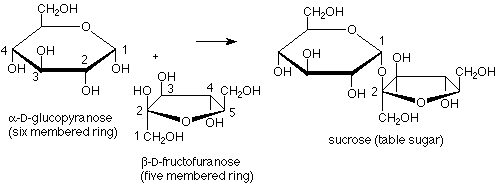
La fructosa proporciona un ejemplo de un disacárido en el que el enlace acetal une los carbonos anoméricos de una molécula de glucosa al carbono anomérico de una molécula de fructosa. En este caso no existe un grupo funcional hemiacetal, por lo que la fructosa es un azúcar no reductor. Además, aquí uno de los anillos tiene cinco miembros en lugar de seis, lo que demuestra que la ciclación de fructosa desde la forma de cadena abierta a la forma cíclica hemiacetal utiliza el OH en el carbono 5 y el carbonilo-carbono 2.
También podemos observar con más cuidado la fructosa. En su forma cíclica el carbono anomérico (hemiacetal) está involucrado en dos enlaces carbono-carbono. Esto significa que cuando abrimos la molécula hasta su forma de cadena abierta, el carbono anomérico se convierte en un grupo ceto-carbonilo. La fructosa es así un ejemplo de una cetosa, un azúcar en el que el grupo carbonilo es una cetona en lugar de un aldehído.
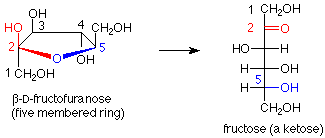
Polisacáridos
Si ahora volvemos a nuestro primer vistazo a los polisacáridos, podemos ver que el almidón de amilosa está compuesto por muchas unidades de monosacáridos de glucosa que están unidas entre sí por grupos funcionales acetales que involucran el carbono anomérico de una glucosa y el carbono número cuatro de la siguiente glucosa. La repetición de este patrón muchas veces da el polímero.
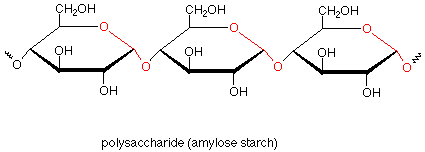
La amilosa es un polímero lineal con pocas ramas. En la amilopectina, otro tipo de almidón, existen ramas que involucran enlaces acetales a través del oxígeno sobre el carbono 6. El glucógeno, a veces llamado almidón animal, es un polímero similar que se encuentra en los animales como medio de almacenamiento de glucosa. El glucógeno es aún más ramificado que la amilopectina.
La hidrólisis del almidón implica la escisión de los grupos funcionales acetales con la adición de una molécula de agua por cada enlace acetal y la producción de muchas moléculas de glucosa. Esto lo hacen las enzimas llamadas glicosidasas que se encuentran en la saliva. Estas enzimas funcionan solo en enlaces alfa acetales y no atacan los enlaces beta. Dichos enlaces beta se encuentran en la celulosa. Dado que nuestras glicosidasas son incapaces de hidrolizar los enlaces beta en la celulosa, no podemos digerir la celulosa, aunque también es un polímero de glucosa.
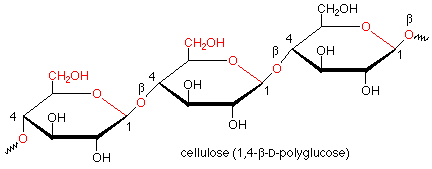
Por supuesto, existen enzimas que hidrolizan los enlaces beta en la celulosa. Tales enzimas se encuentran en las bacterias que habitan los estómagos de rumiantes como ganado bovino y ovino, lo que hace que la celulosa sea digerible por los rumiantes. También se encuentran en hongos que pudren la madera.
La especificidad de las enzimas permite que un monosacárido, la glucosa, sea el componente básico tanto para el almidón, que pensamos como una fuente importante de energía en nuestros alimentos, como para la celulosa, que vemos como un material estructural en los árboles y un componente principal del papel. Si miramos esto en el contexto del uso de estos materiales en una planta, el almidón se encuentra como medio de almacenamiento de glucosa en semillas y tubérculos. Se utiliza como fuente de glucosa tanto para la energía como como materia prima para la celulosa a medida que la planta brota y entra en su periodo de crecimiento inicial. Enzimas específicas para enlaces alfa presentes en la planta germinadora hidrolizan el almidón a glucosa, como lo hacen en el proceso de malteado utilizado en la producción de cerveza y whisky.
La celulosa producida a medida que la planta crece es un componente estructural importante de la planta. Debe ser bastante estable si va a servir para ese propósito, por lo que las enzimas específicas para el enlace alfa no atacan a sus grupos funcionales beta acetal y no se hidroliza fácilmente. La pequeña distinción estereoquímica entre los enlaces alfa y beta conlleva consecuencias muy grandes en la química y función del almidón y la celulosa.


