1.19: Aminas- Estructura y Síntesis
- Page ID
- 74270
Tipos Estructurales
La última vez completamos nuestro estudio de carbohidratos. Ahora estamos dirigiendo nuestra atención a otra clase importante de compuestos orgánicos, las aminas. Muchos fármacos importantes son las aminas, las bases presentes en el ARN y el ADN son aminas, y los bloques de construcción fundamentales de las proteínas son los aminoácidos.
El grupo funcional de una amina es el átomo de nitrógeno conectado por tres enlaces sigma a grupos alquilo o átomos de hidrógeno. (Los grupos arilo -anillos de benceno- también se pueden conectar a un nitrógeno en aminas, pero no los estudiaremos hasta más adelante en el curso.) La química de las amidas es lo suficientemente diferente de la de las aminas que normalmente no están incluidas entre las aminas. El átomo de nitrógeno de una amina también se puede incluir en un anillo. Tales aminas se llaman “heterociclos”. (Recordemos que el nitrógeno es un heteroátomo —no un carbono o un hidrógeno).
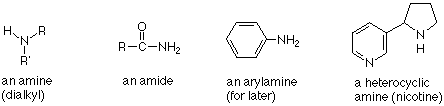
Las aminas se clasifican como primarias, secundarias o terciarias según el número de carbonos unidos directamente al átomo de nitrógeno. Las aminas primarias tienen un carbono unido al nitrógeno. Las aminas secundarias tienen dos carbonos unidos al nitrógeno, y las aminas terciarias tienen tres carbonos unidos al nitrógeno. El sistema es superficialmente similar a la forma en que hemos clasificado los alcoholes, pero la diferencia importante es que en los alcoholes estábamos contando los enlaces al carbono que portaba el grupo OH. Para las aminas, estamos contando los carbonos unidos al nitrógeno.
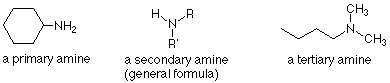
Dado que el nitrógeno tiene una valencia normal de tres, también podemos concluir que hay dos enlaces N-H en aminas primarias y un enlace N-H en aminas secundarias. En las aminas terciarias no hay enlaces N-H.
Vinculación, forma e hibridación
Ahora, veamos la unión alrededor del átomo de nitrógeno de una amina. Primero, hay que recordar que el nitrógeno, además de formar tres enlaces sigma, también porta un par de electrones no compartidos. Esto significa que hay cuatro grupos de electrones asociados con el nitrógeno. La repulsión mutua de estos grupos conduce a un arreglo tetraédrico, muy parecido al de un átomo de carbono típico de sp 3. Esto predice un ángulo de unión entre los enlaces N-H de 109.5 o que concuerda bastante bien con el valor observado de 107 o que se encuentra en el amoníaco (que es la amina “más pequeña”, como el agua es el alcohol más pequeño).
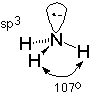
Dado que los enlaces conectados al nitrógeno tienen la forma de una pirámide aplanada, la disposición a menudo se llama piramidal. Esto ignora el par de electrones no compartidos, cuya inclusión conduce a la descripción tetraédrica y a la correspondiente comprensión de la hibridación del nitrógeno como sp 3. El ejemplo utilizado para ilustrar esto es el amoníaco, pero el nitrógeno también se describe bien como que tiene hibridación sp 3 aminas primarias, secundarias y terciarias también.
Enlaces de hidrógeno
Los enlaces N-H en las aminas son algo polares. Como podemos adivinar al considerar las electronegatividades (estimadas a partir de posiciones en la tabla periódica), el enlace N-H es más polar que el enlace C-H y menos polar que el enlace O-H. Esta polaridad se manifiesta en una comparación de las propiedades físicas de aminas y alcoholes.
Los ejemplos más simples son el agua y el amoníaco. El agua hierve a 100 o C, mientras que el amoníaco hierve a -33 o C. Esto se interpreta en el sentido de que se necesita mucha más energía para hervir el agua que el amoníaco. Correspondientemente, las fuerzas entre las moléculas de agua (que resisten separarlas en el proceso de ebullición) son mucho más fuertes que las que existen entre las moléculas de amoníaco. La más importante de estas fuerzas se llama el enlace de hidrógeno.
El enlace de hidrógeno es mucho más débil que un enlace covalente. Romper un enlace de hidrógeno requiere aproximadamente el 10% de la energía requerida para romper un enlace covalente típico. Esto es consistente con el hecho de que podemos hervir agua sin romper ningún enlace covalente (las moléculas de agua permanecen intactas). La separación de una molécula de otra solo requiere romper los enlaces de hidrógeno más débiles.
Una imagen útil de un enlace de hidrógeno es electrostática, una atracción entre el extremo positivo de un dipolo en una molécula y el extremo negativo de un dipolo en otra. Cuanto más polares sean las moléculas, mayor será el grado de carga positiva y negativa asociada con los dipolos, y más fuertes serán los enlaces de hidrógeno. En amoníaco y agua, la región con carga negativa más concentrada y disponible es donde está el par de electrones no compartidos. Las regiones cargadas positivamente son los extremos de hidrógeno de los enlaces N-H. Podemos imaginar el enlace de hidrógeno como una atracción débil (en comparación con los enlaces covalentes) entre los pares de electrones no compartidos de un nitrógeno en una molécula y un hidrógeno (unido covalentemente al nitrógeno) en otra.
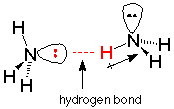
Los enlaces de hidrógeno son extremadamente importantes en la química del código genético. Como estudiaremos más adelante, las cadenas dobles del ADN se mantienen unidas por enlaces de hidrógeno. La replicación del ADN depende de enlaces de hidrógeno que conectan selectivamente pares de bases específicos, al igual que los diversos pasos mediante los cuales el mensaje genético determina el orden específico de los aminoácidos en una proteína.
Aminas como Bases
La propiedad química distintiva de las aminas es que son bases. Esto es consecuencia directa de la presencia del par de electrones no compartidos en el nitrógeno, lo que los convierte en bases Lewis. El par básico de electrones no compartidos está menos apretado por el nitrógeno de una amina que el oxígeno correspondiente de un alcohol, lo que lo hace más disponible para actuar como base. En consecuencia, las aminas (y el amoníaco) son más básicas que los alcoholes (y el agua), y menos básicas que los iones alcóxido (RO -) e hidróxido (OH -). Es conveniente pensar en la fuerza base de aminas y amoníaco en términos del pK a de sus ácidos conjugados, los iones amonio. Estas ideas se pueden resumir en el siguiente esquema, donde utilizamos agua y amoníaco como soportes para alcoholes y aminas:
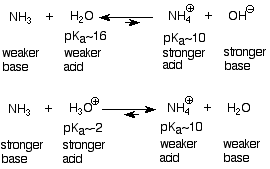
Como hemos llegado a esperar, estas reacciones van en la dirección que consume las bases y ácidos más fuertes y genera las más débiles. Los iones amonio (pK a ~10) son ácidos más fuertes que el agua (pK a ~16, por lo que el agua se produce cuando un ion amonio se trata con ion hidróxido. Los iones amonio (pK a ~10) son ácidos más débiles que H 3 O + (pK a ~-2), por lo que se producen cuando las aminas se tratan con soluciones acuosas de ácidos minerales fuertes como los ácidos sulfúrico o clorhídrico. Si se elimina el agua, queda una sal de amonio que incorpora el contraión negativo del ácido mineral (sulfato o cloruro).
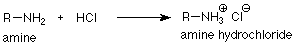
Dado que las propiedades básicas de las aminas surgen de la presencia del par de electrones no compartidos sobre el nitrógeno, las resistencias de las aminas primarias, secundarias y terciarias son bastante similares. Aril aminas (aquellas donde el nitrógeno está conectado directamente a una amina aromática) bases más débiles, pero vamos a retomar ese tema más adelante en el curso.
Síntesis de Aminas
Nuestro último tema para hoy es la síntesis de aminas. Si bien es posible hacer alquilaminas (un ejemplo que es una amina primaria con un grupo alquilo primario) serían RCH 2 NH 2) por reacción de un haluro primario con amoníaco, estas reacciones rara vez son muy prácticas.
Los planteamientos más prácticos para hacer alquilaminas implican reacciones que son reducciones. El primero de ellos es una reacción de una amida con hidruro de litio y aluminio. El efecto general de esta reacción es reemplazar el oxígeno carbonílico de la amida con dos hidrógenos de hidruro de litio y aluminio. No discutiremos el mecanismo, pero es probable que comience con el familiar ataque nucleofílico del hidruro (H: - del hidruro de litio y aluminio sobre el carbono carbonílico de la amida. (Esta reacción se discute en la Sección 13.8B de Brown.)
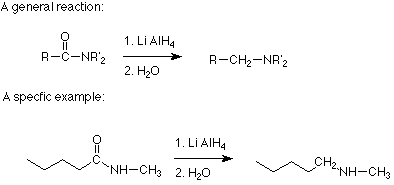
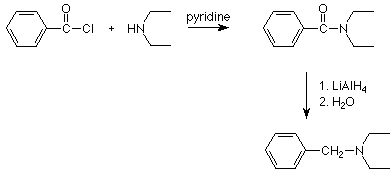
Observe que cualquier otro átomo o grupo alquilo unido al nitrógeno de la amida no se cambia. Dado que las amidas se preparan comúnmente mediante la reacción de cloruros de ácido con una amina, la secuencia de dos etapas que comienza con la reacción de una amina (o amoníaco) con un cloruro de ácido y sigue con la reducción de la amida usando hidruro de litio y aluminio da como resultado la sustitución de un grupo alquilo en el nitrógeno. Aquí hay un ejemplo:
Otra síntesis reductora de aminas reacciona un nitrilo (RCN) con hidrógeno en presencia de un catalizador que es níquel muy finamente dividido. Esta reacción agrega dos moléculas de H2 al triple enlace del nitrilo, y produce una amina primaria de alquilo primaria (RCH 2 NH 2. El hidruro de litio y aluminio también llevará a cabo esta reducción.
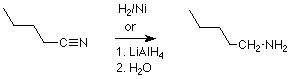
Recordemos que los nitrilos se hacen comúnmente por la reacción de haluros de alquilo primarios con cianuro de sodio o potasio, y nuevamente tenemos una secuencia de dos etapas como en este ejemplo:
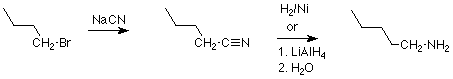
Finalmente, también existe un método reductor que implica una reacción de cetona o aldehído carbonilo. A principios del curso se estudió una reacción entre aminas primarias y cetonas o aldehídos que resultó en la sustitución del oxígeno carbonílico por el nitrógeno de la amina. Se eliminó el agua y el producto fue una imina.
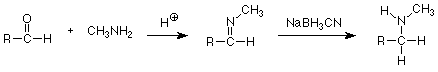
Si esta reacción se lleva a cabo en una solución que contiene cianoborohidruro de sodio (NaBH 3 CN, un análogo menos reactivo de borohidruro de sodio) la imina se reduce a una amina a pesar de que también hay un grupo carbonilo reducible en la mezcla de reacción. La formación de ácido glutámico (del cual surgen los grupos amino de todos los demás aminoácidos por transaminación) es un análogo biológico de esta “aminación reductora”. Aquí el agente reductor es NADPH +, uno de varios agentes reductores que son comunes en las reacciones bioquímicas.
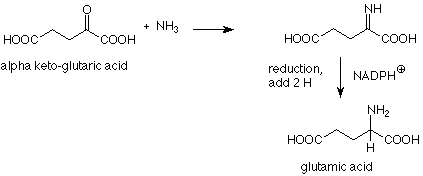
Nuevamente, vemos que las reacciones bioquímicas utilizan mecanismos de reacción orgánicos.
Colaboradores
Kirk McMichael (Washington State University)


