1.28: Polímeros
- Page ID
- 74337
Polímeros - Estructura y Respuesta al Calor
Comencemos por notar algunas características importantes del mundo real de los polímeros. Si bien todas contienen moléculas con cadenas muy largas, existen algunas diferencias importantes entre las propiedades de diferentes tipos de polímeros. La mayoría de los polímeros se forman en las formas deseadas después de ablandarse o fundirse por calentamiento. Algunos, como el familiar polietileno y poliestireno, pueden fundirse y remodelarse una y otra vez. A estos se les llama polímeros termoplásticos.
Otros se carbonizan o queman cuando se recalientan. A estos se les llama polímeros termoendurecibles. Los ejemplos incluyen baquelita y caucho vulcanizado. La diferencia estructural entre estos polímeros es que los polímeros termoestables tienen reticulaciones entre las cadenas y los polímeros termoplásticos no. Cuando se calienta un polímero termoplástico, las cadenas son libres de moverse una junto a la otra haciendo que la muestra sea menos rígida y eventualmente fundirla. Esto no puede suceder con un polímero termoendurecible, ya que sus cadenas están bloqueadas entre sí por los eslabones cruzados. La energía del calor eventualmente debe entrar en enlaces de ruptura que conducen a la descomposición del polímero.
Esta vista esquemática sugiere la diferencia:
Notamos reticulación antes cuando vimos cómo el entrecruzamiento disulfuro formado por la oxidación del grupo SH en cisteína era importante para mantener la estructura de la proteína.
Unidades Repisibles y Monómeros
Dado que los polímeros se fabrican uniendo entre sí muchas moléculas pequeñas idénticas, hay unidades repetitivas en los polímeros. Aquí un ejemplo, el cloruro de polivinilo, en el que la unidad repetitiva es -CH 2 -CHCl-.
En poli (cloruro de vinilo) la unidad repetitiva proviene directamente de la unión de extremo a extremo de muchas moléculas de cloruro de vinilo. Una molécula de la que está hecho un polímero se llama monómero. Cada molécula de monómero de cloruro de vinilo aporta un grupo CH 2 unido a una unidad de CHCl por un enlace sencillo. Este enlace sencillo es un remanente del doble enlace que unió esos grupos en la molécula de cloruro de vinilo. Esto es justo lo que sucede en una reacción de adición de un alqueno. Veremos cómo una reacción de adición conduce a tales polímeros en algunos párrafos.
Las unidades repetitivas también se pueden hacer a partir de dos monómeros. Aquí hay un ejemplo:
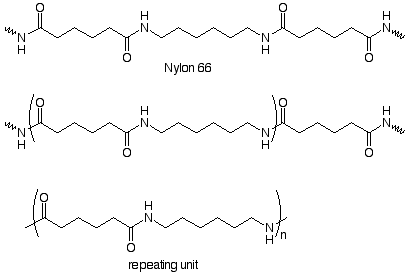
Observamos que la unidad repetitiva está unida al resto de la cadena por grupos funcionales amida, y que la unidad repetitiva contiene un grupo amida. Podemos deducir la estructura de los monómeros imaginando los compuestos que podrían usarse para hacer el grupo amida. En el proceso industrial estos son un ácido dicarboxílico (ácido adípico) y una diamina (1,6-hexanodiamina). Estos forman una sal cuando se disuelven en alcohol. La sal se calienta a 250 o bajo presión para formar los enlaces amida. El resultado es Nylon 66.
Polímeros de crecimiento escalonado
Los polímeros formados de esta manera, donde ambos extremos de la cadena en crecimiento tienen grupos funcionales que pueden reaccionar con un monómero o con el grupo funcional apropiado en otra cadena, se denominan polímeros de crecimiento escalonado. Veamos otro polímero de crecimiento escalonado, pero esta vez veremos los monómeros y propondremos una estructura para el polímero que resultaría.
Los monómeros son un ácido dicarboxílico (ácido tereftálico) y un dialcohol, también llamado diol (etilenglicol). Inmediatamente reconocemos que estos monómeros pueden hacer un éster, por lo que esperamos que nuestro polímero esté unido por grupos funcionales éster. El polímero resultante se llama tereftalato de polietileno y es el poliéster común de las botellas de plástico pop y las telas de poliéster.
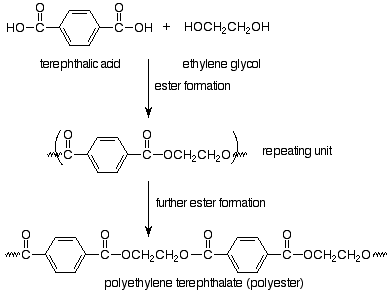
Observe que al elegir cómo representar la unidad repetitiva en polímeros de crecimiento escalonado, hemos elegido la unidad repetitiva particular (de varias posibilidades) que está unida al resto del polímero a través de enlaces de grupos funcionales. En el caso del Nylon, el enlace del grupo funcional es un enlace amida, por lo que el Nylon es una poliamida (de esa manera como una proteína). El término poliéster también pone nuestro foco en el grupo funcional que se elabora en la reacción de polimerización. La polimerización por crecimiento escalonado implica reacciones normales de grupos funcionales. Los polímeros resultan porque los monómeros tienen dos grupos funcionales por molécula.
Polímeros de crecimiento en cadena
Los polímeros resultantes de adiciones a alquenos son polímeros de crecimiento de cadena. En estos procesos cada etapa de adición da como resultado una cadena más larga que termina en un sitio reactivo. El mecanismo de cada etapa de adición es el mismo, y cada etapa de adición agrega otro monómero para extender la cadena en una unidad repetitiva.
Cada paso en esta formación de polímero es una adición a un alqueno. El mecanismo es en la mayoría de los casos una adición de radicales libres. En las reacciones de radicales libres el par pi de electrones se separa. Uno de estos electrones se empareja con un electrón del reactivo atacante para formar un enlace sigma con uno de los carbonos de alqueno y el otro electrón permanece unido al otro carbono alqueno. (Las flechas curvas con una sola “púa” en un punto se utilizan para seguir la trayectoria de un solo electrón de la misma manera que las flechas de “doble cabeza” siguen la trayectoria de un par de electrones). Los intermedios con un electrón desapareado se denominan radicales libres, por lo que este paso puede describirse como agregar un radical libre a un alqueno para alargar la cadena en dos carbonos y generar un nuevo radical libre. A su vez este nuevo radical libre puede agregarse a otra molécula de monómero y continuar el proceso.
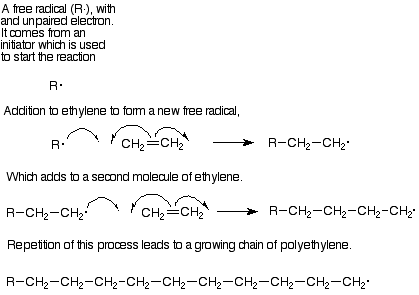
Los monómeros más importantes para este proceso son etileno (que hace que el polímero sea polietileno) y etilenos sustituidos como cloruro de vinilo (cloruro de polivinilo), estireno (feniletileno, poliestireno), metacrilato de metilo (plexiglás) y acrilonitrilo (cianoetileno, fibras acrílicas). El Cuadro 15.1, p 427 en Brown enumera las estructuras de estos monómeros, de los cuales se pueden deducir las estructuras de los polímeros.
Podríamos preguntarnos sobre la orientación del ataque de un radical sobre un monómero de etileno (vinilo) sustituido. Se ha demostrado que la orientación es la misma que para una adición electrófila, es decir, el radical libre ataca a los carbonos menos sustituidos de los dos alquenos para producir el nuevo radical libre en el carbono más substitado. Aquí hay un ejemplo para el estireno:
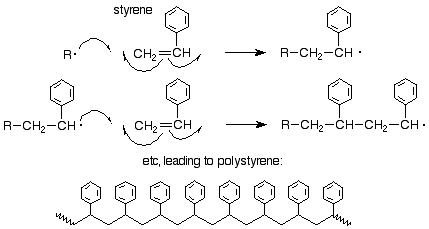
También se conocen otros métodos de polimerización. La más importante es la polimerización Ziegler-Natta que utiliza una combinación de TiCl 4 y un compuesto de alquil aluminio como Al (CH 2 CH 3) 3. Este proceso se discute con más detalle en la Sec. 15.5B de Brown.


