1.29: Reacciones metabólicas orgánicas
- Page ID
- 74311
Beta-oxidación de ácidos grasos
Hoy vamos a examinar una selección de procesos que ocurren en el metabolismo. Nos centraremos en comparar estas reacciones con reacciones que ya hemos estudiado. En particular veremos que las reacciones que rompen los enlaces carbono-carbono son solo versiones inversas de las condensaciones de aldol y Claisen que hemos estudiado anteriormente. Tenga en cuenta que mientras buscamos conexiones entre estas reacciones y reacciones orgánicas familiares, todos los pasos en estos esquemas son catalizados por enzimas.
Los dos procesos que vamos a estudiar son ambos procesos catabólicos, es decir, son procesos que descomponen y oxidan moléculas más grandes para producir moléculas más pequeñas y energía. La primera, la beta-oxidación, es una parte clave del proceso por el cual los ácidos grasos se descomponen en acetato. [El acetato es la base conjugada del ácido acético. Dado que un pH neutro es más básico que el pK a del ácido acético (~5), en solución neutra el ácido acético está predominantemente ionizado y el acetato es la forma principal presente.] El esquema general de beta-oxidación se ve así:
De esto podemos ver que el resultado de un “evento” de beta-oxidación es que dos átomos de carbono se escinden de un ácido graso. El enlace roto se encuentra entre los carbonos alfa y beta. (Esto explica el término “beta-oxidación”.) El carbono gamma aparece en el producto como un ácido carboxílico. Este ácido carboxílico, dos carbonos más cortos que su “parental”, se puede acortar por otro viaje a través del proceso de beta-oxidación, con la producción de otra molécula de acetato y un nuevo ácido graso, nuevamente dos carbonos más cortos. No es sorprendente que todas las reacciones ocurran en el extremo ácido carboxílico de la molécula y no en el extremo CH 3, ya que una idea fundamental de la química orgánica es que las reacciones ocurren en grupos funcionales y no en otros lugares.
Antes del inicio del ciclo real de beta-oxidación, el extremo ácido carboxílico del ácido graso se esterifica con el grupo SH de la Coenzima-A. Esta reacción se discute con más detalle en la Sec 20.3A en Brown. Aquí está el esquema ya que se ve de manera más realista con la Coenzima-A incluida.
Ahora veamos las reacciones individuales de este proceso. (Observe el esquema de notación ligeramente diferente. El reactivo principal y el producto están conectados por una flecha recta. Los reactivos necesarios y sus subproductos están conectados por una flecha curva). La primera reacción resulta en la eliminación de los átomos de hidrógeno de los átomos alfa y beta carbo. Sus efectos son opuestos a los de la hidrogenación de un doble enlace. La eliminación de los átomos de hidrógeno hace de esta una reacción de oxidación. El agente oxidante es una molécula llamada “FAD” (para flavina adenina dinucleótido). Veremos su estructura más adelante.
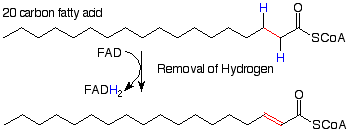
Luego se agrega agua al enlace alqueno pi que resulta de la primera reacción. Esto es análogo a la adición de agua a los alquenos que estudiamos recientemente. Ya que sabemos que un carbono alfa a un grupo carbonilo es un lugar bastante nuclofílico (¿recuerdas enolatos? ), tiene sentido que el hidrógeno electrófilo del agua se agregue allí y el OH nucleófilo se agregue en el carbono beta.
Tan pronto como veamos el tercer paso,
reconocemos la oxidación de un alcohol secundario a una cetona. Esta es una reacción para la que utilizamos reactivos cromo-6 antes, pero ahora el agente oxidante es NAD + (catión dinucleótido de nicotina adenina). El hidrógeno unido al carbono que lleva OH se transfiere al NAD +, y el hidrógeno OH sale como un H +.
El paso final es la escisión real del enlace entre el carbono beta y el grupo carbonilo gamma. Para poner esto en contexto, tenemos que pensarlo a la inversa. Cuando hacemos eso, vemos un patrón que es idéntico a la condensación de Claisen.
La conclusión es que el paso final en el ciclo de beta-oxidación es una condensación inversa de Claisen. Al igual que la propia condensación de Claisen, este paso es posible porque el ion enolato obtenido a medida que se rompe el fragmento de acetato se estabiliza por resonancia. Este ion enolato es neutralizado por una fuente de protones (ácido). El ácido graso acortado se libera de la enzima como CoA? SH reemplaza el azufre de la enzima. Esta última etapa pasa por un intermedio tetraédrico (no mostrado) como se esperaría para una reacción que convierte un derivado de ácido carboxílico en otro.
La acetil-coenzima-A formada en este ciclo ingresa al ciclo del ácido tricarboxílico donde se oxida a dos moléculas de CO 2. El NADH y el FADH 2 producidos en la beta-oxidación y el ciclo del ácido tricarboxílico entran en un proceso llamado fosforilación oxidativa que da como resultado la formación de ATP (trifosfato de adenosina) para su uso en el suministro de energía dentro de la célula. No vamos a retomar estos últimos procesos, pero son una parte importante de un curso de bioquímica.
Glicólisis
Nuestro siguiente tema es la glucólisis. Esta es la conversión de glucosa a piruvato. En el esquema más amplio de las cosas el piruvato producido se convierte luego en acetato, que al igual que el acetato de la beta-oxidación de ácidos grasos, entra en el ciclo del ácido tricarboxílico. Nuevamente, estaremos viendo las reacciones involucradas tratando de encontrar analogías en reacciones orgánicas que hemos estudiado. El gráfico de la Fig 20.2 (p 571) en Brown presenta todo el esquema de glucólisis. Por favor refiérase a esa tabla para identificar las reacciones que estamos considerando.
La reacción 1 es una esterificación. Se asemeja a la conversión de un alcohol en un éster por un cloruro de ácido. En la Reacción 1, se usa ATP en lugar de un cloruro de ácido, y el resultado es un éster de ácido fosfórico en lugar de un éster de un ácido carboxílico.
La reacción 2 es formalmente una reacción interna de oxidación-reducción. El grupo carbonilo de la glucosa se reduce a un alcohol primario mientras que el grupo OH en el carbono-2 de la glucosa se oxida a una cetona. La reacción pasa por un enol como se muestra en la p 572 de Brown.
La reacción 3 es similar a la reacción 1, la formación de un éster de fosfato (esto se llama reacción de fosforilación).
La reacción 4 implica la escisión de un enlace carbono-carbono y es la reacción en la que el esqueleto de carbono cambia de una cadena de seis carbonos a dos cadenas de tres carbonos. Lo primero que hay que notar es que el enlace carbono-carbono roto une un carbono que es alfa a un grupo carbonilo a uno que es beta. Esto sugiere que la reactividad enol y enolato va a ser importante. Como hicimos con la beta-oxidación de los ácidos grasos, podemos ver una reacción familiar si pensamos en ésta en la dirección inversa, es decir, mirarla como una reacción de formación de enlaces más que una reacción de ruptura de enlaces. Si ignoramos los grupos que no cambian, podemos ver que nuestra reacción es una adición inversa de aldol.
Con más detalle, las etapas aldólicas inversas en esta reacción van precedidas por la conversión del grupo carbonilo de fructosa 1,6-bisfosfato en una imina, y seguido de la hidrólisis de esa imina de nuevo a un grupo carbonilo y al grupo amino. El grupo amino se une a la enzima que cataliza esta reacción, y la formación de la imina ayuda a anclar la molécula de fructosa 1,6-bisfosfato a la enzima en la posición adecuada para llevar las bases y ácidos de la enzima a la ubicación correcta para que el mecanismo avance. La secuencia de pasos mecanicistas es:
La reacción 5 convierte dihidroxiacetona fosfato en gliceraldehído 3-fosfato. Esto es como el reverso de la reacción 2 en que pasa por un intermedio enol para oxidar un grupo OH a un carbonilo en un átomo y reducir un carbonilo a un OH en el carbono adyacente. La secuencia está en la p 574 en Brown. En este punto de la glucólisis una molécula de glucosa se ha convertido en dos moléculas de gliceraldehído 3-fosfato.
La reacción 6 es una oxidación del aldehído en gliceraldehído 3-fosfato a un ácido carboxílico. El agente odxidante es NAD +, el cual se reduce a NADH. El proceso también incluye la formación de un anhídrido entre el ácido carboxílico recién formado y una molécula de ion monohidrógeno fosfato. Este anhídrido es bastante reactivo (ya que el fosfato es un anión estable, es un buen grupo de salida muy parecido al cloruro) a lo largo de las líneas de un cloruro de ácido.
La reacción 7 explota la reactividad de este anhídrido mixto utilizándolo para transferir el fosfato a ADP. El ATP resultante se utiliza como fuente de energía para muchos procesos celulares, por lo que este paso en la glucólisis produce directamente energía para la célula.
La reacción 8 desplaza el grupo fosfato del OH en el carbono 3 al OH en el carbono 2. Es como una hidrólisis de éster en un carbono y una esterificación en el otro.
La reacción 9 es una reacción de deshidratación. Se asemeja a la deshidratación de ciclohexanol a ciclohexeno que hicimos en laboratorio, aunque las condiciones en una célula son mucho más suaves ya que las eficiencias enzimáticas hacen innecesario emplear ácidos fuertes y calor. El producto es un enol fosfato (el ácido fosfórico de una cetona).
La reacción 10 hace dos cosas. Al igual que la reacción 7 transfiere un fosfato a ADP, produciendo ATP, y produce la forma enol de piruvato que se equilibra rápidamente a la forma keto.
Si sumamos todas las reacciones equilibradas, encontramos que una molécula de glucosa, dos moléculas ADP, dos moléculas NAD + y dos moléculas de fosfato de hidrógeno se han convertido en dos piruvatos, dos ATP, dos NADH y dos iones hidronio.
Destinaciones del piruvato
¿Qué pasa con el piruvato? Esto depende de las condiciones locales. En el tejido muscular puede haber un suministro limitado de oxígeno (debido a las demandas de ejercicio superando la capacidad del cuerpo para suministrar oxígeno al tejido). Esto significa que el NADH producido en la glucólisis no se oxida de nuevo a NAD +. La glucólisis requiere NAD +, por lo que se detendría y junto con ella la producción de energía en forma de ATP. Esto puede ser evitado por la fermentación de lactato, que reduce el pirvato a lactato y oxida el NADH a NAD +. La producción de energía puede continuar hasta que la acumulación de lactato y ácido como resultado de esta reacción (Brown, p 577) agote el músculo.
En las levaduras en ausencia de oxígeno, se produce la fermentación a alcohol. Esta es la base de los procesos de fermentación que producen bebidas alcohólicas en cerveza y vino. El subproducto es el CO 2 que es responsable de la carbonatación de la cerveza y los vinos espumosos. Si la levadura se usa en la cocción, el CO 2 expande la masa para producir el “aumento” de la masa de pan. En este caso el alcohol es el subproducto y en gran parte es impulsado por el calor de la cocción. También es responsable de gran parte del agradable olor de hornear pan.
Si hay un buen suministro de oxígeno, el piruvato se oxida a acetil CoA y CO 2. Como hemos visto ahora varias veces, el agente oxidante es NAD + el cual se reduce a NADH. Esta reacción es más compleja de lo que parece a primera vista, pero dejaremos esas complejidades para un curso de bioquímica.


