1.3: Percepción de las relaciones estructura-funcionalidad
- Page ID
- 70178
La explotación de la funcionalidad en la planificación sintética requiere una comprensión de las interrelaciones entre las reacciones químicas y la funcionalidad. Esto se logra de manera más efectiva en términos de mecanismos básicos de reacción electrónica que permiten una clasificación muy compacta y sistemática de cientos de reacciones sintéticas. Por ejemplo, consideremos sistemáticamente las relaciones que aquí existen entre la estructura molecular y la funcionalidad con respecto a las reacciones polares.
Cambios en el nivel de funcionalidad
Para el análisis sintético orgánico se suele suponer que todos los centros de carbono en un hidrocarburo no se activan hacia reacciones formadoras de enlaces C-C polares, de ahí que el nombre parafina (del latín parum affinis = poca afinidad) denota falta de reactividad relativa. El esqueleto hidrocarbonado de las moléculas orgánicas se considera un conglomerado homogéneo de átomos de carbono no reactivos. Es útil definir el nivel de funcionalidad 9 de un átomo como f = el número de electrones de valencia en el átomo neutro menos el número de electrones asignados al átomo por el siguiente protocolo: todos los electrones de enlace se dividen por igual entre C-C, C=C, C≡ C, C-H, M-M o X-X, pero todos los electrones de unión se dan a los mejores nucleófugos (a menudo pero no siempre el átomo más electronegativo, vide infra) para los enlaces C-X, C-M o X-Y, donde X e Y son heteroátomos, y M es un metal. Así, por ejemplo, los electrones tomados o dados al carbono al romper los siguientes enlaces al carbono se asignan de la siguiente manera: RO-, RS- (-1); O= (-2); F-, Cl-, Br-, o I- (-1); R 2 N-, R 2 P- (-1); RN= (-2); N≡ (-3); Li-, Na-, K-, R 2 Al-, R 3 Si- (+1).
La aproximación del nivel de funcionalidad enfatiza la similitud entre los carbonos funcionalizados de manera similar. Así, el nivel de funcionalidad de todos los carbonos en un hidrocarburo es cero. Es decir, en un hidrocarburo todos los átomos de carbono, ya sean cuaternarios, terciarios, secundarios o primarios, comparten un nivel de funcionalidad común (f = 0). Asimismo, todos los átomos de carbono de carbinol comparten un nivel de funcionalidad común (f = +1) independientemente de que sean primarios, secundarios o terciarios. Los aldehídos y cetonas comparten un nivel de funcionalidad común (f = +2). Para los químicos orgánicos estas conclusiones de similitud son aceptadas tácitamente. Las aproximaciones de nivel de funcionalidad difieren de las realizadas para definir el estado de oxidación x = el número de electrones de valencia en el átomo neutro menos el número de electrones asignados al átomo por el siguiente protocolo: todos los electrones de enlace se dividen por igual entre C-C, C=C, C≡C, M-M o X-X, pero todos los electrones de unión se dan al elemento más electronegativo para enlaces entre diferentes elementos. 10 Es de poca importancia para un químico orgánico que los estados de oxidación del carbono carbonílico en formaldehído (x = 0), otros aldehídos (x = +1) y cetonas (x = +2) difieran al igual que los estados de oxidación de primario (x = -1), secundario ( x = 0), o terciario (x = +1) carbonos de carbinol. Los contrastes anteriormente mencionados entre las aproximaciones de estado de oxidación y nivel de funcionalidad resultan del hecho de que en efecto, la aproximación del nivel de funcionalidad asigna un número de oxidación de 0 para el hidrógeno cuando se une al carbono en contraste con la aproximación del estado de oxidación que asigna una oxidación número de +1.
Como veremos, el concepto de nivel de funcionalidad es útil en el contexto de reacciones polares que son aquellas que dan como resultado la formación de enlaces por donación de pares de electrones de un sintón rico en electrones (nucleófilo) a un sintón deficiente en electrones (electrófilo). En este contexto, por ejemplo, los químicos orgánicos generalmente consideran que todos los haluros de metilo, es decir, fluoruro, cloruro, bromuro, yoduro, están funcionalizados de manera similar, y por lo tanto es apropiado que todos compartan f = +1. Es de poca importancia (y probablemente no ampliamente conocido) que los estados de oxidación de los carbonos en yoduro de metilo (x = -4) y bromuro de metilo (x = -2) sean diferentes.
Las interconversiones de grupos funcionales de diferente nivel de funcionalidad corresponden a oxidaciones o reducciones:
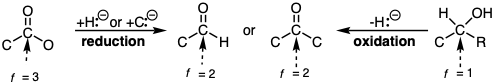
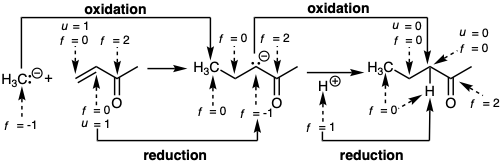
La heterólisis del enlace C-H se considera un modo especial de reacción C-H que da como resultado la funcionalización de un hidrocarburo. Si se abstrae el hidruro, la reacción se considera oxidación mientras que la abstracción de protones se considera reducción.
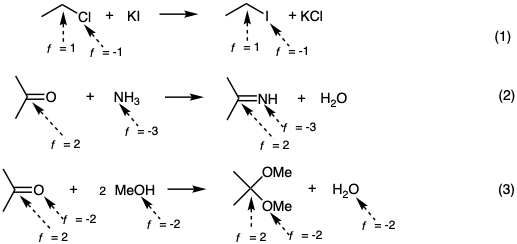
Todos los grupos funcionales del mismo nivel de funcionalidad son, en principio, interconvertibles por metatesias o reacciones polares de adición y eliminación como en las ecuaciones 1-3.
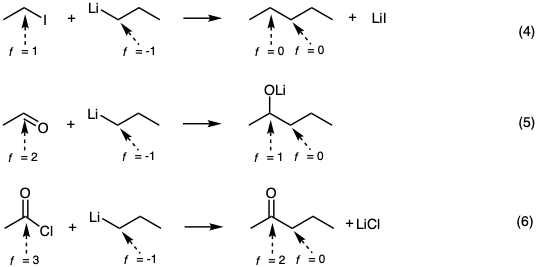
Para el análisis sintético orgánico, es importante reconocer que las reacciones de formación de enlaces carbono-carbono polares son procesos redox. El nucleófilo de carbono se oxida y el electrófilo de carbono se reduce. En términos de los niveles de funcionalidad de carbono en reacciones polares hipotéticas representativas; la sustitución nucleofílica, la adición nucleofílica y la sustitución de acilo nucleofílico se indican en las ecuaciones 4-6 respectivamente.
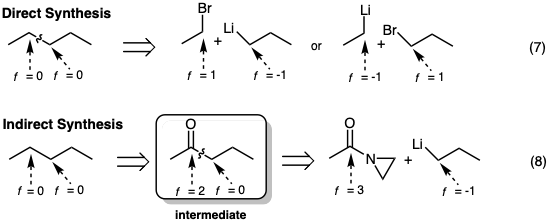
Así, si deseamos un producto sin funcionalidad (f = 0) debemos planear reaccionar un electrófilo (+1) con un nucleófilo (-1) (ecuación 7). Alternativamente, podemos usar reactivos de otro nivel de funcionalidad, pero el nivel de funcionalidad del producto inicial tendrá que cambiarse (oxidación o reducción) después de la formación del enlace C-C (por ejemplo, ecuación 8).
Cambios en el Nivel de Insaturación
Si la funcionalidad de carbono se define como carbono para el cual f = 0, entonces los enlaces C=C y C≡C no se consideran como funcionalidad. Claramente, entonces, la funcionalidad no es la única característica molecular (rasgo estructural) que facilita las reacciones formadoras de enlaces. Para considerar sistemáticamente las relaciones que aquí entre la estructura molecular y las reacciones polares, es útil definir el nivel de instauración de un átomo específico como u = 0 para todos los átomos unidos de manera individual, como u = 1 para todos los átomos involucrados en el doble enlace homonuclear, y como u = 2 para todos los átomos involucrados en el triple enlace homonuclear. 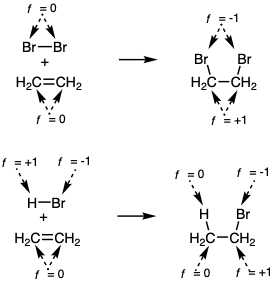 Así, la unión múltiple carbono-carbono y homonuclear en general no cambia los niveles de funcionalidad. La introducción de la instauración C-C se considera como activación en lugar de oxidación (aumento del nivel de funcionalidad). La hidrogenación de la instauración C-C se considera como saturación en lugar de reducción del nivel de funcionalidad. Estas convenciones encuentran analogía en los conceptos de la instauración coordinativa en la química organometálica. Así, la reactividad depende de f y u. Los cambios en f durante las reacciones químicas siempre están equilibrados, es decir, un aumento de f para un átomo requiere una disminución de f para otro átomo. Por ejemplo, la adición de bromo a C=C da como resultado la oxidación de ambos C's y la reducción de ambos Br (de f = 0 a f = -1).
Así, la unión múltiple carbono-carbono y homonuclear en general no cambia los niveles de funcionalidad. La introducción de la instauración C-C se considera como activación en lugar de oxidación (aumento del nivel de funcionalidad). La hidrogenación de la instauración C-C se considera como saturación en lugar de reducción del nivel de funcionalidad. Estas convenciones encuentran analogía en los conceptos de la instauración coordinativa en la química organometálica. Así, la reactividad depende de f y u. Los cambios en f durante las reacciones químicas siempre están equilibrados, es decir, un aumento de f para un átomo requiere una disminución de f para otro átomo. Por ejemplo, la adición de bromo a C=C da como resultado la oxidación de ambos C's y la reducción de ambos Br (de f = 0 a f = -1).
La adición de HBr a C=C da como resultado la oxidación de un C (el que recibe Br) mientras que\(H\oplus\) se reduce a H•. El concepto de nivel de funcionalidad se corresponde bien con la experiencia en su mayor parte. Aunque las diferencias sintéticamente valiosas en la reactividad química son alcanzables para los enlaces 1°, 2° y 3° C-H de hidrocarburos, es útil considerarlos como diferentes proclividades hacia la oxidación (abstracción de hidruro) o reducción (abstracción de protones).
Un aumento del nivel de funcionalidad del nucleófilo de carbono también acompaña a la adición de conjugados nucleofílicos. Pero el electrófilo de carbono no se reduce. Más bien,\(H\oplus\) se reduce a H• y el nivel de instauración del electrófilo de carbono disminuye.