2.2: Síntesis de Azúcares
- Page ID
- 70251
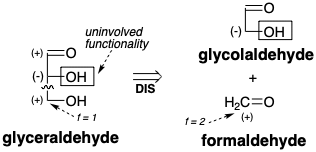 El análisis retrosintético revela que se puede lograr una síntesis polar de gliceraldehído mediante la condensación de un sintón de glicolaldehído nucleofílico con formaldehído, un electrófilo de un carbono de con f = 2. De hecho, la condensación aldólica catalizada por bases de glicolaldehído con formaldehído no solo genera gliceraldehído sino también dihidroxiacetona a través de la tautomerización a un endiol y eritulosa a través de condensación aldólica con un segundo equivalente de formaldehído. 1 Se cree que estas reacciones están involucradas en la oligomerización catalizada por bases de formaldehído que genera los mismos productos. Una pequeña cantidad de glicolaldehído es suficiente para acelerar la oligomerización que de otro modo tiene un largo período de inducción, pero finalmente procede con la misma cinética que el proceso promovido por glicolaldehído. Bajo ciertas condiciones, tanto como 50% del formaldehído se convierte en glicolaldehído, aparentemente a través de la tautomerización de eritrulosa a eritrosa que luego experimenta escisión retro aldólica a dos moléculas de glicolaldehído. Así, el periodo de inducción en la ologomerización del formaldehído presumiblemente corresponde a un proceso lento que genera las primeras trazas de glicolaldehído que luego cataliza una mayor ologomerización. Una hipótesis es que la formación de glicolaldehído a partir de dos moléculas de formaldehído implica la abstracción de protones para generar una pequeña concentración de acilcarbanión que se condensa con una segunda molécula de formaldehído. 1 Una posibilidad alternativa es que una cicloadición 2πs+2πa térmicamente permitida (ver capítulo 3, página 67) proporcione un intermedio de dioxetano que sufra desproporción catalizada por bases al hidroxialdehído.
El análisis retrosintético revela que se puede lograr una síntesis polar de gliceraldehído mediante la condensación de un sintón de glicolaldehído nucleofílico con formaldehído, un electrófilo de un carbono de con f = 2. De hecho, la condensación aldólica catalizada por bases de glicolaldehído con formaldehído no solo genera gliceraldehído sino también dihidroxiacetona a través de la tautomerización a un endiol y eritulosa a través de condensación aldólica con un segundo equivalente de formaldehído. 1 Se cree que estas reacciones están involucradas en la oligomerización catalizada por bases de formaldehído que genera los mismos productos. Una pequeña cantidad de glicolaldehído es suficiente para acelerar la oligomerización que de otro modo tiene un largo período de inducción, pero finalmente procede con la misma cinética que el proceso promovido por glicolaldehído. Bajo ciertas condiciones, tanto como 50% del formaldehído se convierte en glicolaldehído, aparentemente a través de la tautomerización de eritrulosa a eritrosa que luego experimenta escisión retro aldólica a dos moléculas de glicolaldehído. Así, el periodo de inducción en la ologomerización del formaldehído presumiblemente corresponde a un proceso lento que genera las primeras trazas de glicolaldehído que luego cataliza una mayor ologomerización. Una hipótesis es que la formación de glicolaldehído a partir de dos moléculas de formaldehído implica la abstracción de protones para generar una pequeña concentración de acilcarbanión que se condensa con una segunda molécula de formaldehído. 1 Una posibilidad alternativa es que una cicloadición 2πs+2πa térmicamente permitida (ver capítulo 3, página 67) proporcione un intermedio de dioxetano que sufra desproporción catalizada por bases al hidroxialdehído.
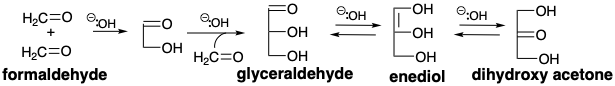
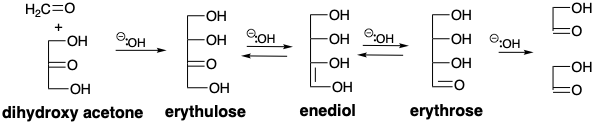
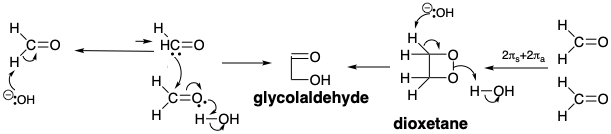
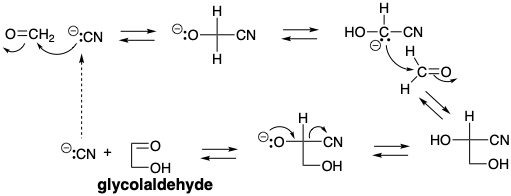
La oligomerización del formaldehído para proporcionar una variedad de azúcares es una ruta probable (pre) biosintética para la generación de estas moléculas en un mundo prebiótico. En el mundo prebiótico, es probable que la formación de glicolaldehído se haya producido principalmente a través de una condensación catalizada por cianuro que involucra un intermedio de carbanión de cianhidrina.
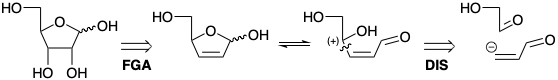
La mayor complejidad molecular de los azúcares hereda en su abundancia de funcionalidad y estereoquímica. Una estrategia para la síntesis total de ribosa aprovecha la perspectiva de la hidroxilación cis estereoespecífica para introducir dos grupos hidroxilo con el estereocontrol requerido. La ribosa existe predominantemente en forma de hemiacetal cíclico. Se puede esperar que el anillo de 5 miembros relativamente rígido favorezca el estereocontrol apropiado. La desconexión de un precursor de alqueno cis en el carbono del carbinol sugiere la adición de un carbanión vinílico con glicolaldehído.
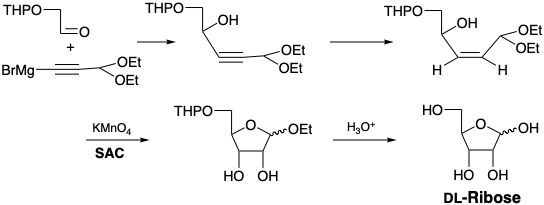
Se requieren dos refinamientos para implementar esta estrategia. El hidroxilo glicolaldehído debe estar enmascarado para evitar la protonación del carbanión y un grupo aldehído debe enmascararse como acetal. En lugar de un carbanión vinílico, se eligió un acetilido como nucleófilo con la perspectiva de hidrogenación parcial cis estereoespecífica de un alquino disustituido como ruta hacia el alqueno cis requerido. 2
En la ruta biosintética a cetosas como Ru5P de G3P, el pirofosfato de tiamina sirve como catalizador para proporcionar un equivalente de un glicolaldehído con reactividad polar invertida del grupo carbonilo. Una estrategia de condensación aldólica para la síntesis conectiva C-C de ribulosa es sugerida por la nucleofilia latente del α-carbono permitido por el grupo carbonilo de la dihidroxiacetona para reaccionar con un electrófilo de glicolaldehído.
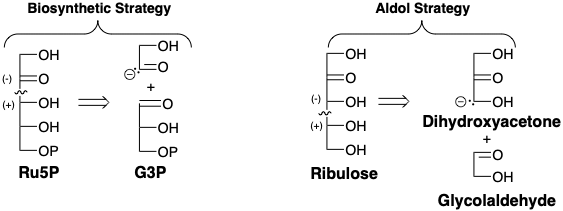
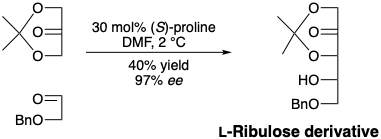
La biosíntesis de azúcares genera enantiómeros individuales debido a la asimetría de las enzimas que catalizan su formación. Los azúcares generados por la oligomerización catalizada por hidróxidos de formaldehído son una mezcla de estereoisómeros que son todos racémicos. Sin embargo, se puede lograr catálisis asimétrica en síntesis conectiva de aldol C-C usando (S) -prolina quiral no racémica como catalizador para promover la condensación aldólica de acetónido de dihidroxiacetona con el éter bencílico de gliceraldehído. 3