3.7: Levuglandinas
- Page ID
- 70162
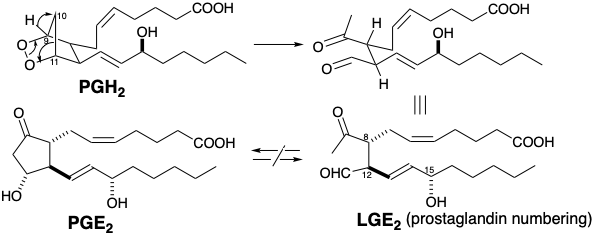
El reordenamiento de PGH 2 inducido por agua ocurre rápidamente en las condiciones de su biosíntesis para generar PGE 2, PGD 2 y dos derivados de levulinaldehído de seco-prosta-glandina conocidos como levuglandinas (ver sección 4.1). Así, por ejemplo, la migración intramolecular del hidruro de la posición 9 a la 10 en PGH 2 acompañada de la escisión del enlace 10,11-C-C y el enlace peróxido O-O genera levuglandina (LG) E 2. Esta levuglandina está formalmente relacionada con PGE 2 por condensación aldólica, aunque nunca se ha observado interconversión de PGE 2 con LGE 2.
Enantiocontrol con un auxiliar quiral
La disponibilidad de abundantes insumos para pruebas biológicas y confirmación de la estructura de LGE 2 dependió del desarrollo de una síntesis total asimétrica eficiente. Otra estrategia para derivar asimetría a partir de materiales de partida naturales no racémicos quirales es utilizarla como auxiliar quiral (vide infra), como se ilustra por una síntesis de LGE 2 a partir de L-arabinosa. 23 Una consideración dominante en la planificación de una síntesis total de LGE 2 es su proclividad hacia la deshidratación, epimerización en las posiciones 8 y 12 (numeración de prostaglandinas) y reordenamiento alílico del enlace 14-15 (numeración de prostaglandinas) C=C en conjugación con el aldehído carbonilo. Muchas de estas dificultades se eluden reemplazando el aldehído carbonilo por un equivalente latente, un diol vecinal como en 303. La conversión de 303 en LGE 2 debe ser alcanzable en condiciones excepcionalmente suaves por escisión oxidativa con peryodato. El estereocontrol es un reto más difícil en la síntesis total de LGE 2 que para la síntesis total de PGE 2 ya que la LGE 2 es acíclica y, por lo tanto, más conformacionalmente móvil que la PGE 2 que tiene tres de sus cuatro estereocentros dispuestos en el termodinámicamente prefirió la configuración todo-trans alrededor de un anillo de ciclopentanona relativamente rígido.
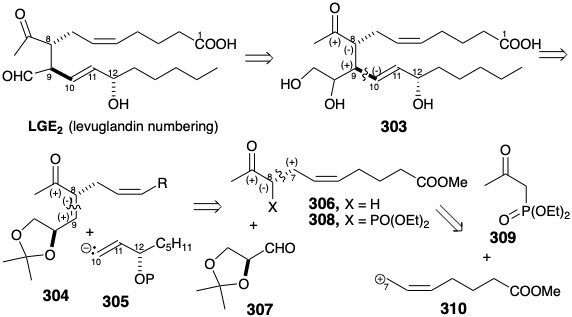
La táctica de usar un diol vecinal como grupo aldehído latente aparentemente complica más que simplifica la diana sintética al agregar un cuarto estereocentro. Por el contrario, este centro adicional de quiralidad, que no se incorporará en el producto final, es la clave para la generación enantioselectiva de la configuración absoluta correcta en la posición 9 (numeración de levuglandina). Además, la configuración correcta en la posición 8 debería estar disponible por epimerización de cualquier 8-epi 303 que pudiera generarse. El análisis polar 303 sugiere la posibilidad de explotar la electrofilicidad en la posición 9 proporcionada por el acetil carbonilo como en 304 para permitir la formación de enlaces polares con un sintón vinílico nucleófilo no racémico quiral 305. Lo más importante es que tales adiciones de conjugados son altamente diastereoselectivas. Se espera que el sustituyente alcoxi vecino fomente la generación de solo la confuguración absoluta requerida en la posición 9 durante la adición 1,4-de un nucleófilo de cuprato de vinilo a 304. Un análisis polar adicional de 304 sugiere la generación de esta enona por condensación aldólica de un nucleófilo enolado con el aldehído 307, L-gliceraldehído acetónido. Este material de partida no racémico quiral está fácilmente disponible a partir de L-arabinosa (vide infra). Debido a que su centro quiral proporciona enantiocontrol pero no se incorpora al producto final, 307 se dice que sirve como auxiliar quiral (una unidad quiral que se incorpora en un intermedio para sesgar la estereoselectividad de una o más reacciones posteriores después de lo cual es escindido del sustrato o se elimina su centro quiral). Para activar la generación de enolato y controlar la regioquímica de la condensación aldólica, se agrega un grupo dietilfosfono a 306 como en 308. La explotación adicional de la activación polar proporcionada por los grupos acetil carbonilo y fosfono debería permitir la construcción de 308 por alilación de 309 con el electrófilo 310 de la cadena lateral superior.
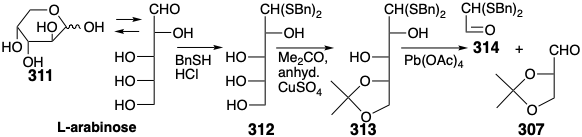
Una síntesis del auxilar quiral 307 a partir de L-arabinosa comienza con la intercepción de la aldosa acíclica desde su equilibrio con una piranosa forma 311 por tioacetalización con bencilmercaptano. La cetalización selectiva del tetraol 312 resultante proporciona monoacetónido 313. La escisión oxidativa de este último produce 307 en mezcla con 314 de los cuales se separa fácilmente por destilación. 24
Se realizó una síntesis total corta, altamente estereocontrolada y asimétrica de LGE2 23 a partir de la 1- (dietilfosfono) -2-propan-ona (309) comercialmente disponible que se aliló en buen rendimiento con bromoéster 315. La reacción secundaria principal fue la dialilación. La olefinación de Horner-Emmons del acetónido de L-gliceraldehído (307) con el carbanión derivado de 308 entrega en excelente rendimiento una mezcla de isómeros geométricos E-304 y Z-304 en una proporción de 2. 3:1. No es necesario separar esta mezcla porque cualquiera de los isómeros reacciona estereoselectivamente (es decir, SEC) con cuprato 316 para entregar una mezcla 7:3 idéntica de 317 y su diastereómero 8-epi con excelente rendimiento. Esta reacción clave resultó refractaria. Poca o ninguna adición de 1,4-se pudo lograr hasta que se descubrió que el anhidro\(\ce{MgBr2}\) cataliza la reacción requerida presumiblemente sirviendo como un ácido de Lewis que potencia la electrofilicidad de la enona 304. Nuevamente la separación de productos isoméricos es innecesaria porque la saponificación del éster diastereomérico 317 u 8-epi-317 genera una mezcla idéntica 7:3 de los ácidos carboxílicos correspondientes. Esta es aparentemente la relación de equilibrio.
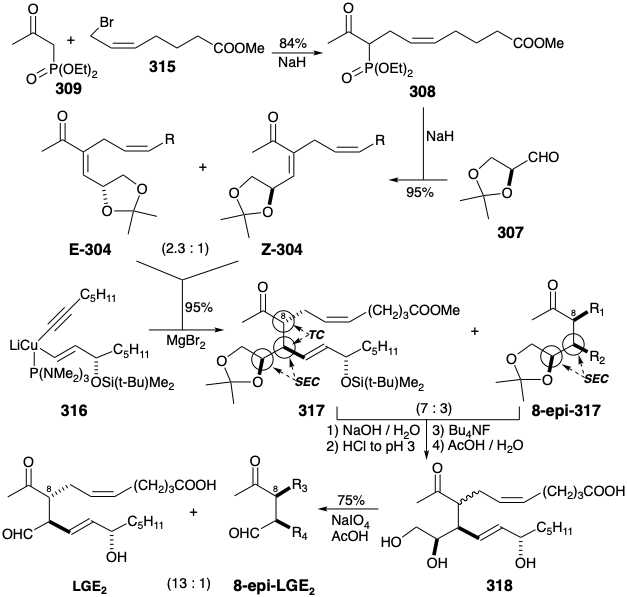
Lo más afortunadamente, la separación de los ácidos diastereoméricos también fue innecesaria porque cualquiera de los ácidos isoméricamente puros dio la misma mezcla 13:1 de LGE 2 y su diastereómero 8-epi tras la desililación seguido de hidrólisis catalizada por ácido del acetónido y finalmente escisión con peryodato del resultante diol vecinal. La diastereoselectividad favorable de la epimerización catalizada por ácido que acompañó a la decetalización del diol vecinal fue completamente inesperada. El diol vecinal también juega un papel importante en este proceso fortuito. Así, la epimerización ocurre en 318 pero no en LGE 2 o 8-epi-LGE 2 bajo estas condiciones para hidrólisis y escisión oxidativa.


