4.1: Biosíntesis de Monoterpenos- Loganin
- Page ID
- 70283
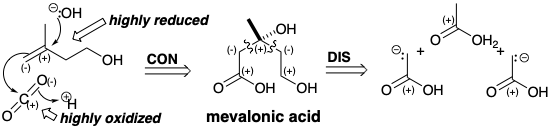
Los terpenos tienen una gran variedad de esqueletos de carbono caracterizados por cadenas ramificadas y, a menudo, complejos sistemas de anillos multicíclicos. Son oligómeros de la unidad biológica de isopreno, Δ 3 -isopentenol, que es un hidrocarburo relativamente reducido compuesto por cinco carbonos. Se produce en la naturaleza a partir de tres moléculas de un material de partida de dos carbonos relativamente oxidado, ácido acético en forma de acetil CoA. Un candidato probable para el subproducto que contiene el átomo de carbono perdido de tres moléculas de ácido acético durante la biosíntesis de Δ 3-isopentenol es el dióxido de carbono. El análisis polar sugiere un precursor más oxidado, el ácido mevalónico, que podría descarboxilarse por fragmentación polar de una\(\ce{CO2}\) electrofuga y un nucleófugo de hidróxido. Tal fragmentación puede beneficiarse de la ventaja termodinámica de generar un enlace C=O y produce subproductos altamente oxidados fácilmente desechables,\(\ce{CO2}\) y agua. El análisis retrosintético adicional del ácido mevalónico sugiere una desconexión polar a dos carbaniones sintones de ácido acético que se condensarían con un acetilo electrófilo.
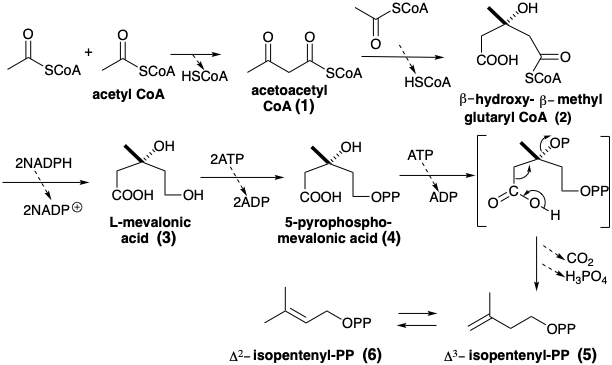
Una gran variedad de lípidos se derivan en la naturaleza de la oligomerización de Δ 3-pirofosfato de isopentenilo (5). Este bloque de construcción biosintético de cinco carbonos se produce por condensación de tres moléculas de acetil CoA. El acetoacetil CoA (1), producido por la condensación de Claisen de dos moléculas de acetil CoA, reacciona en la cetona carbonilo con un segundo equivalente de acetil CoA como nucleófilo. Esta condensación es enantioselectiva. La asimetría de la enzima, hidroximetilglutaril CoA sintetasa, dirige el ataque del nucleófilo acetil CoA a un lado del electrófilo de acetoacetil CoA proquiral. El producto es simétrico. Sin embargo, la condensación va acompañada de la hidrólisis enantioselectiva del éster CoA-SH derivado del grupo acetilo. El monotioéster 2 se reduce luego por ataque de hidruro en el tioéster carbonilo más electrófilo para dar ácido L-mevalónico (3). Fosforilación de 3 derivaciones, a través de un 5-monofosfato y 5-pirofosfato, a un intermedio inestable fosforilado en el hidroxilo C-3. Este fosfato terciario se somete fácilmente a eliminación descarboxilativa para dar 5-3-isopentenilo pirofosfato que isomeriza fácilmente a δ 2-isopentilpirofosfato.
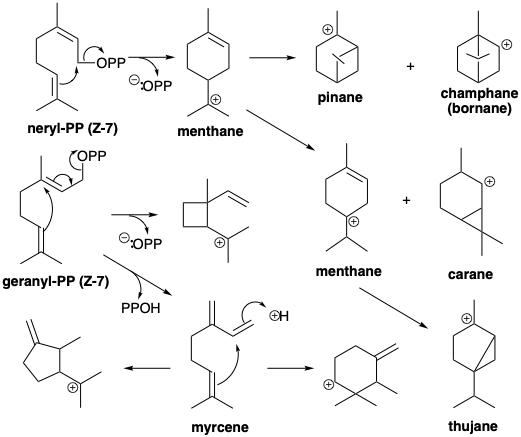
Un dímero cabeza a cola, pirofosfato de geranilo (E-7), se forma mediante la adición del electrófilo alílico 6 a la olefina terminal 5 acompañado de pérdida de protones. El pirofosfato alílico de diez carbonos resultante E-7 alquila fácilmente una segunda molécula de 5 para dar un trímero, el pirofosfato alílico de quince carbonos pirofosfato farnesilo (E-8). Los monoterpenos son compuestos C10 derivados biogenéticamente del pirofosfato de geranilo (E-7), su isómero Z pirofosfato de nerilo (Z-7), o de un dímero de ciclopropilo, pirofosfato de crisantemilo (9), que se forma directamente a partir de dos moléculas de Δ 2 -pirofosfato de isopentenilo. Las unidades de isopreno son frecuentemente discernibles incrustadas en los esqueletos de los terpenos. Sin embargo, algunos terpenos, por ejemplo derivados del catión santolinilo, no están compuestos completamente de unidades de isopreno intactas debido a reordenamientos durante su biosíntesis (vide infra). A estos se les llama terpenos irregulares.
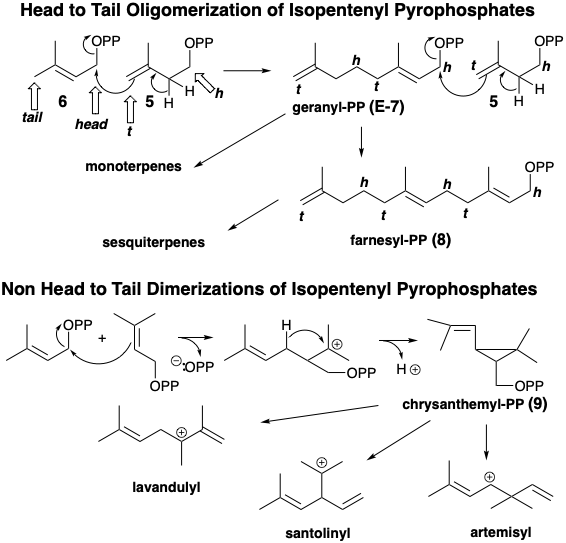
El ataque nucleofílico intramolecular por un enlace p C=C sobre el pirofosfato electrófilo genera diversos intermedios carbocatiónicos isoméricos como mentano, pinano, carano, canfano o tujano-carbenio.
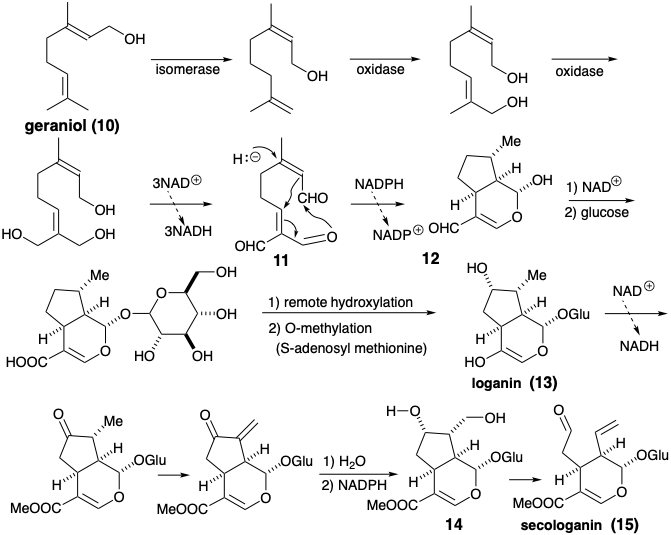
La loganina monoterpénica es el precursor biosintético de la secologanina, un producto natural cuyo origen terpenoide no es obvio. La secologanina, cuyas unidades de isopreno no están intactas, se deriva biosintéticamente por una escisión polar del anillo ciclopentano de loganina explotando la activación polar que proporciona el sustituyente hidroxilo del ciclo pentano.
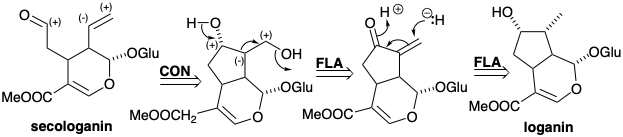
El análisis polar de loganina muestra que el sustituyente hidroxilo no es esencial para facilitar la generación del anillo ciclopentano mediante la formación de un enlace C-C polar ya que la funcionalidad adecuada se localiza en la proximidad del enlace clave. En la biosíntesis de la loganina, este grupo hidroxilo se introduce al final de la síntesis por una oxidación remota. El dihidropirano es simplemente un derivado de un 1,5-dialdehído cuya estructura se simplifica por la desconexión polar de un enlace C-C de anillo localizado entre dos grupos funcionales consonantes. Esta dislocación representa una adición retro de Michael. El nucleófilo requerido podría generarse por desprotonación de un precursor saturado. Un precursor alternativo para este nucleófilo, el implicado en la biosíntesis, es un aldehído insaturado. Así, la adición conjugada de hidruro a un aldehído a, b-insaturado proporciona el nucleófilo que será Michael alquilado. El sustrato de ciclación altamente oxidado se deriva del geraniol por múltiples oxidaciones alílicas, y el geraniol es un dímero de dos precursores de isopentenol, Δ 2 y Δ 3 -isopentenol.
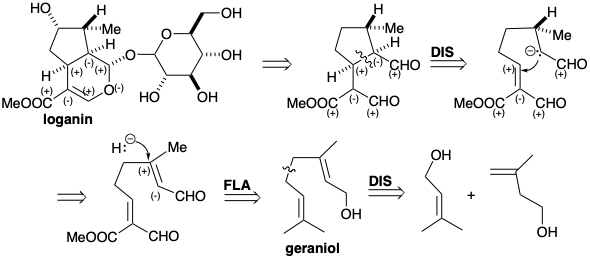
Loganin (13), el glucósido (un acetal mixto de glucosa y un alcohol) de un monoterpeno, es un intermedio clave, que proporciona secologanina (14), el precursor inmediato de la porción no triptamina de los grupos corynanthe, aspidosperma, iboga, ipecacuanha y cinchona de alcaloides indol (ver capítulo 7). Loganin se produce a partir del geraniol (10), el cual primero se oxida a un trialdehído (11). La ciclación reductora de 11 a 12 es seguida de oxidaciones adicionales. La hidroxiloganina (14) da secologanina (15) mediante una escisión Retro-prins. El origen de la secologanina a partir de precursores isoprenoides no es inmediatamente evidente a partir de un examen superficial de su estructura.