2.1: Reacciones Enantioselectivas de Ene y Cicloadición
- Page ID
- 73411
Las reacciones de Alder-eno y Diels-Alder son procesos pericíclicos de seis electrones entre un “dieno” o un alqueno que porta un hidrógeno alílico y un enlace múltiple deficiente en electrones para formar dos enlaces σ con migración del enlace π. La conferencia cubre los ejemplos de desarrollos recientes en glioxilatos enantioselectivos intermoleculares de aliso-eno con alquenos.
Reacción Carbonil-Ene
La reacción de eno enantioselectiva catalizada por ácido de Lewis quiral es uno de los métodos eficientes para la formación de enlaces carbono-carbono económicos de átomos. Por ejemplo, Ti-binol preparado in situ cataliza eficientemente la reacción carbonil-eno del glioxilato con α -metilestireno en presencia de tamices moleculares con alta enantioselectividad (Esquema\(\PageIndex{1}\)).
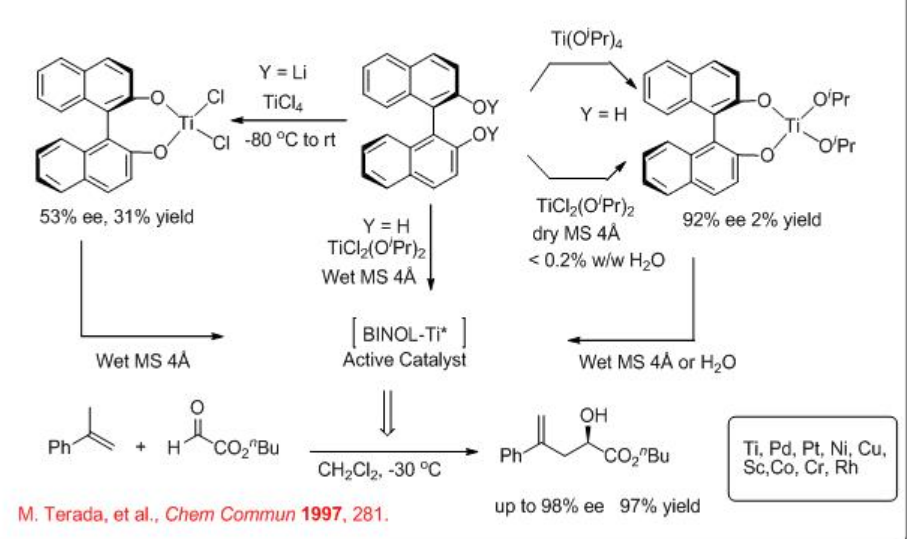
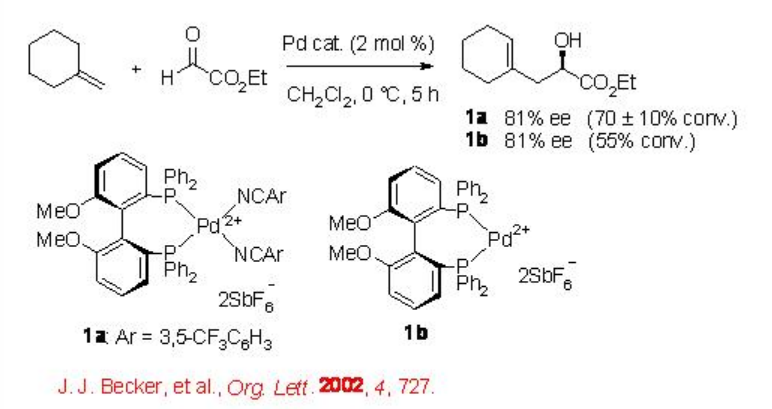
Además de los catalizadores ácidos de Lewis basados en metales de transición tempranos, los complejos de metales de transición tardíos dicatiónicos planos cuadrados que portan ligandos de difosfina C2-simétricos también se han estudiado considerablemente como ácidos de Lewis quirales para reacciones carbonil-eno. Por ejemplo, el complejo MeO-biphep-PD 1a aislado que lleva benzonitrilo aceptor de electrones como ligandos lábiles estabilizantes se ha utilizado para la reacción ene del glioxilato de etilo con hasta 81% ee (Esquema\(\PageIndex{2}\)). El aislado 1a exhibe más actividad catalítica en comparación con el 1b que se genera in situ aunque ambos ofrecen enantioselectividad similar.
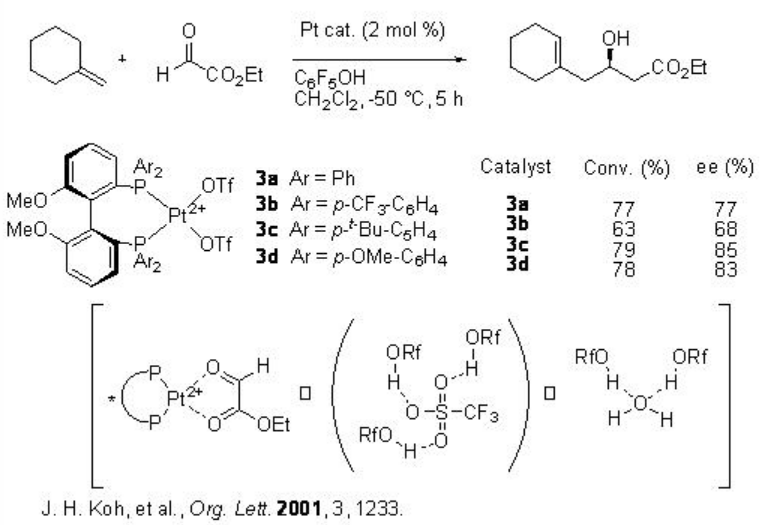
Los complejos MeO-BipHeps-Pt 3 con OtF - como contraanión también exhiben actividad catalítica y selectividad similares en la reacción asimétrica del glioxilato eno (Esquema 3). La adición de fenol facilita la reacción atrapando el anión OTf y trazas de agua.
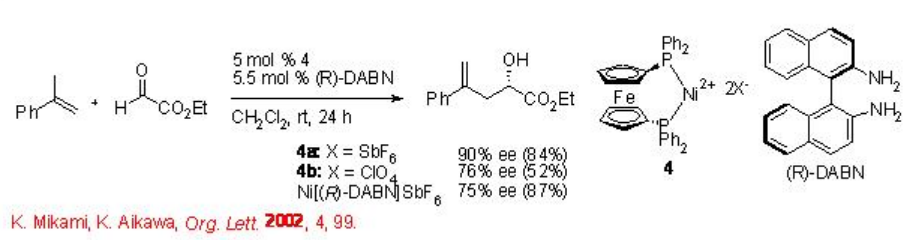
La reacción de glioxilato eno también es efectiva utilizando el complejo DPPF-Ni dicatiónico tropox 4 con enantioselectividad de hasta 90% ee (Esquema\(\PageIndex{4}\)).
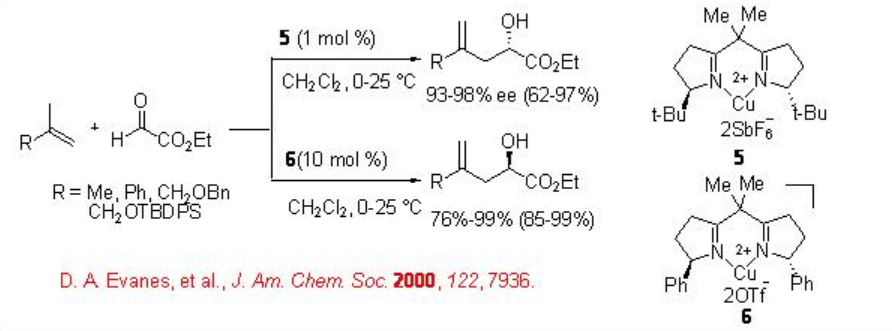
La reacción glioxilato-eno también se puede llevar a cabo utilizando complejos quirales de C2-bisoxazolinil cobre (II) simétrico 5 y 6 como catalizadores ácidos de Lewis (Esquema\(\PageIndex{5}\)). El complejo aqua es estable al aire y al agua y presenta solo una ligera disminución en la velocidad de reacción en comparación con el complejo anhidro 6. El sentido de inducción asimétrica depende de los sustituyentes del anillo oxazolina, los cuales pueden ser racionalizados por los intermedios tetraédricos y planos cuadrados para dar cuenta de la configuración absoluta de los productos.
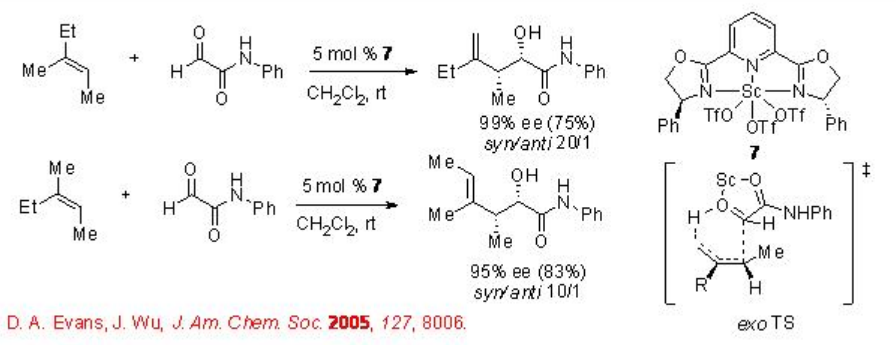
Además, se estudia el complejo quiral C2-simétrico trivalente Pybox-SC 7 para las reacciones carbonil-eno con N-fenil glioxamidas (Esquema\(\PageIndex{6}\)). Los productos ene se obtienen con excelente diastereo- y enantioselectividad. Presumiblemente, los productos se forman mediante transferencia de protones desde el sustituyente β - cis a través de un estado de transición exo.
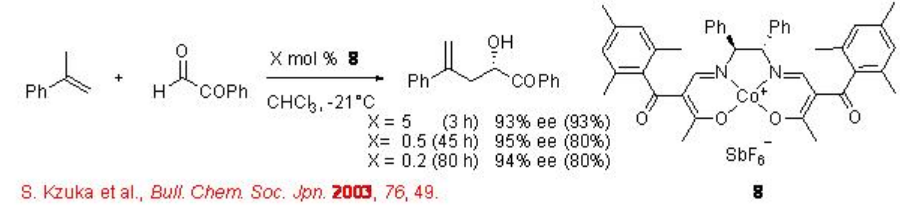
También se han explorado complejos quirales basados en Co y CR para la reacción carbonil-eno con glioxilatos. Por ejemplo, el complejo quiral β-cetoiminato 8 cataliza eficientemente la reacción de alqueno 1,1-disubestimulado y derivado de glioxilo en alta enantioselectividad (Esquema\(\PageIndex{7}\)). Similar a los catalizadores a base de Pd, Pt y Ni descritos anteriormente, se encuentra que el hexafluoroantimonio como contra-anión es el más efectivo.
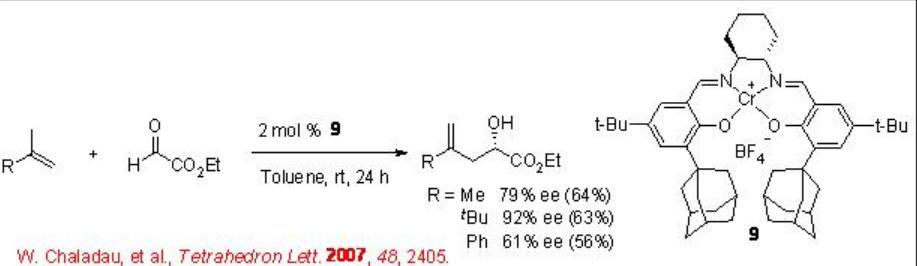
El complejo quiral Cr (III) -salen 9 que porta grupo adamantilo en el ligando salen se ha utilizado para la reacción del glioxilato de etilo con alquenos 1,2-disustituidos (Esquema\(\PageIndex{8}\)). El catalizador se puede preparar en escala multigramo y los productos ene se obtienen con hasta 92% ee. La presencia de sustituyente adamantilo esencial para la potenciación de la enantioselectividad.
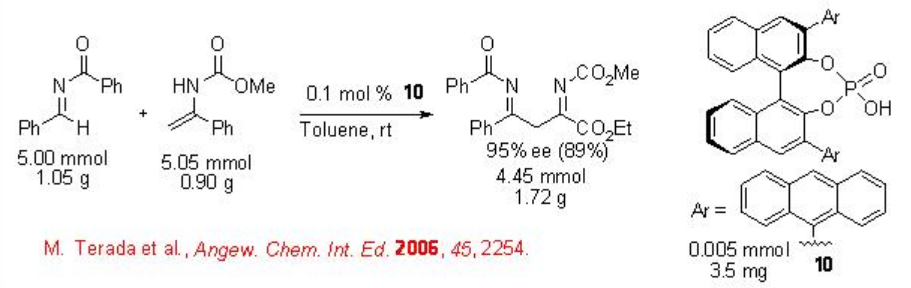
Además de los catalizadores a base de metales, los organocatalizadores quirales también han sido explorados considerablemente durante los últimos años para las reacciones carbonil-eno. Por ejemplo, el ácido fosfórico quiral 10 como ácido de Bronsted quiral cataliza fácilmente la reacción de aza-eno enantioselectiva de enamidas a iminas con excelente enantioselectividad incluso en una escala de gramos (Esquema\(\PageIndex{9}\)).
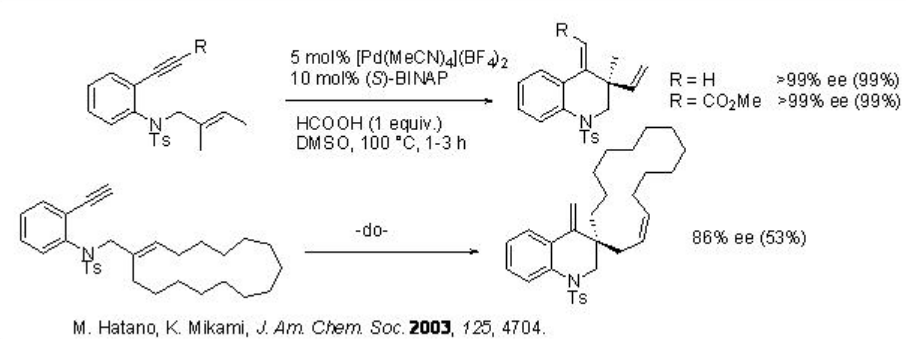
Además de las reacciones intermoleculares, la versión intramolecular de esta reacción también ha sido bien explorada utilizando metales quirales así como ácidos fosfóricos quirales como catalizadores. Por ejemplo, la ciclación catalizada por el complejo de paladio-fosfina de 1,7-enyenos que llevan anillo de benceno se lleva a cabo de manera eficiente para proporcionar derivados de quinolina de seis miembros con centros estereogénicos cuaternarios como enantiómero único (Esquema\(\PageIndex{10}\)).
Reacciones de tipo Diels-Alder
Las reacciones de Diels-Alder intra e intermoleculares asimétricas han logrado avances notables utilizando complejos metálicos quirales como catalizadores. Posteriormente, varios estudios se enfocan en el uso de organocatálisis quiral para esta reacción. Dado que las reacciones basadas en organocatálisis están cubiertas en el módulo I, esta conferencia cubre ejemplos recientes de las reacciones catalizadas por metales.
Cicloadición intramolecular [4+2]
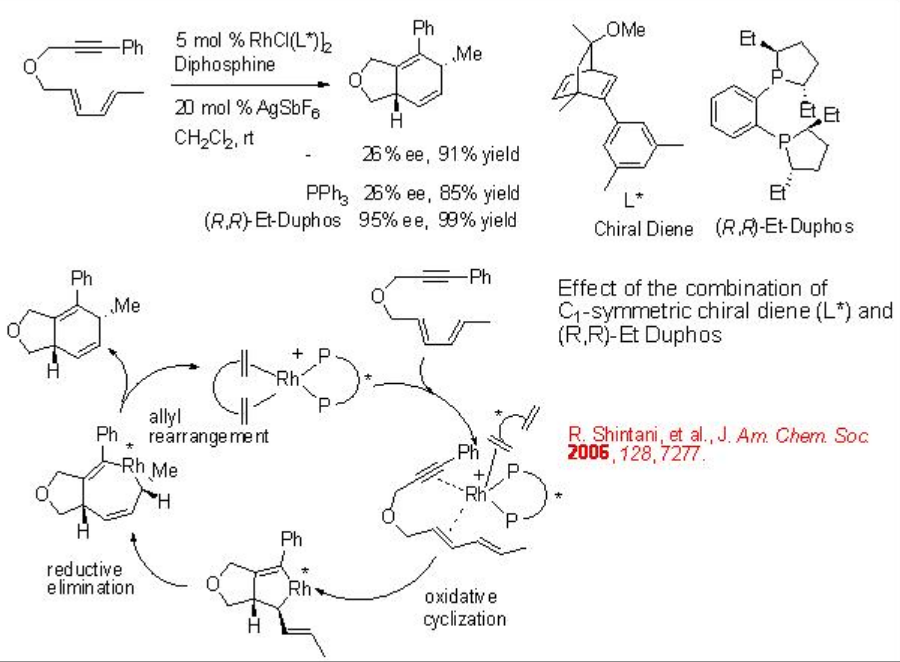
Las reacciones de Diels-Alder intramoleculares de dieneínas inactivadas proporcionan una poderosa herramienta para construir anillos de 5,6 o 6,6 fuzed. Estos anillos fuzed pueden ser inducidos en la síntesis de muchos productos naturales. Por lo tanto, en las últimas dos décadas se han desarrollado varios métodos que utilizan catálisis de metales de transición. Se ha demostrado que el complejo quiral Rh que porta dieno quiral y fosfina quiral proporciona una mejor enantioselectividad en comparación con el complejo de dieno aquiral y fosfina quiral portador (Esquema\(\PageIndex{11}\)).
Reacciones intermoleculares Diels-Alder
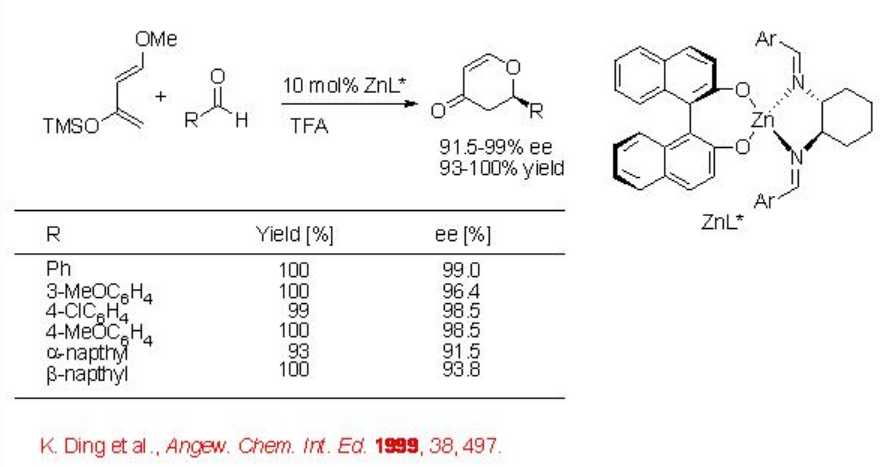
Las reacciones intermoleculares hetero Diels-Alder también han sido ampliamente exploradas utilizando como catalizadores tanto complejos metálicos quirales como organocompuestos quirales. Dado que el uso de organocatálisis quiral ha sido cubierto en el módulo I, esta sección se centra en pocos ejemplos utilizando complejos metálicos quirales como catalizadores. La reacción del benzaldehído con el dieno de Danishefsky procede en presencia de complejo binol/diimina/Zn con excelente enantioselectividad y rendimiento (Esquema\(\PageIndex{12}\)).
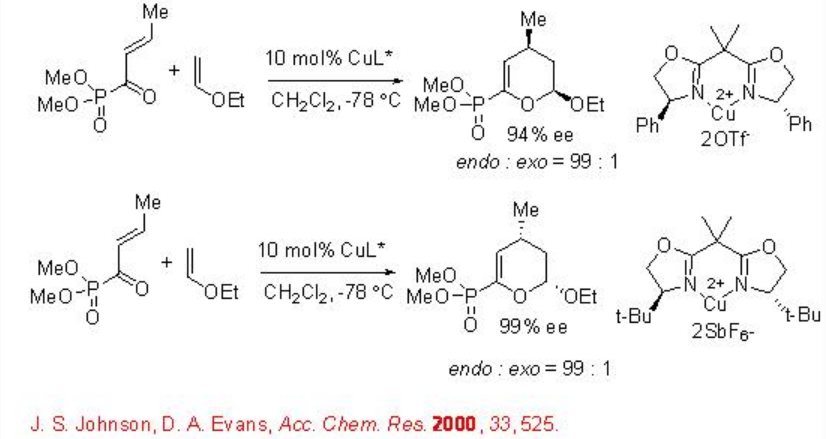
Se encontró que los complejos quirales de caja-Cu (II) son excelentes catalizadores para una variedad de reacciones hetero Diels-Alder (Esquema\(\PageIndex{13}\)).
El catalizador de oxazaborolidina-bromuro de aluminio de fácil acceso cataliza la reacción de furano con fumarato de dietilo con excelente enantioselectividad (Esquema\(\PageIndex{14}\)).
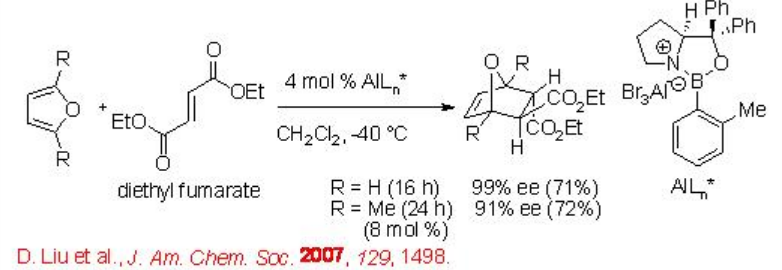
Esquema\(\PageIndex{14}\)


