2.2: Metátesis enantioselectiva de alquenos
- Page ID
- 73383
Entre los catalizadores de metátesis de alquenos, los complejos basados en Mo y Ru han surgido como poderosos mostrando reactividad complementaria y tolerancia a grupos funcionales. La metátesis de alqueno asimétrica proporciona acceso a moléculas enantioméricamente enriquecidas que generalmente no pueden prepararse a través de la estrategia comúnmente practicada. A diferencia de la mayoría de los otros procesos enantioselectivos, la metátesis de alquenos, que conlleva la formación y escisión de dobles enlaces carbono-carbono, no implica la construcción directa del centro estereogénico hibridado sp 3. En cambio, la estereoquímica se crea indirectamente, a menudo por desymmetrización de un sustrato aquiral (Esquema\(\PageIndex{1}\)), en donde el catalizador quiral tiene que discriminar entre grupos enaniotópicos o sitios de la molécula.
Esquema\(\PageIndex{1}\): Desymmetrización en metátesis de alquenos enantioselectivos catalíticos.
Reacciones de metátesis de cierre de anillo (RCM)
2.2.1.1 Reacciones Catalizadas por Ru
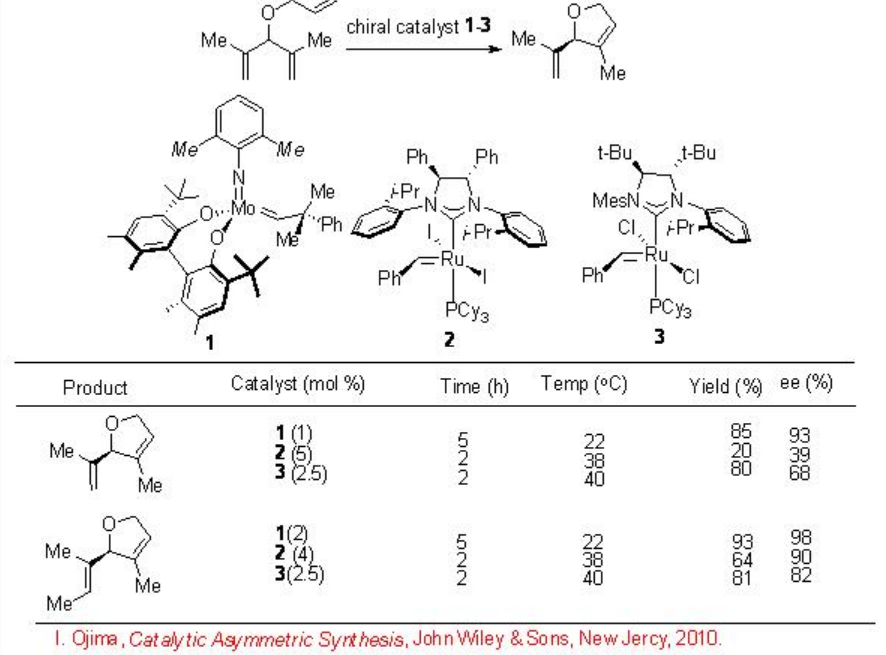
La RCM se usa más comúnmente en la síntesis orgánica para construir sistemas cíclicos, que a veces son difíciles de preparar por la mayoría de los otros métodos. Durante la última década, se han desarrollado varios catalizadores quirales basados en Ru y Mo para el proceso de RCM enantioselectivo y han logrado avances notables. El esquema\(\PageIndex{2}\) resume ejemplos para RCM enantioselectiva empleando complejos monoodentados de NHC-Ru quiral y Mo-diolato quiral. Los catalizadores basados en RU son selectivos en comparación con uno basado en MO, que cataliza una amplia gama de sustratos.
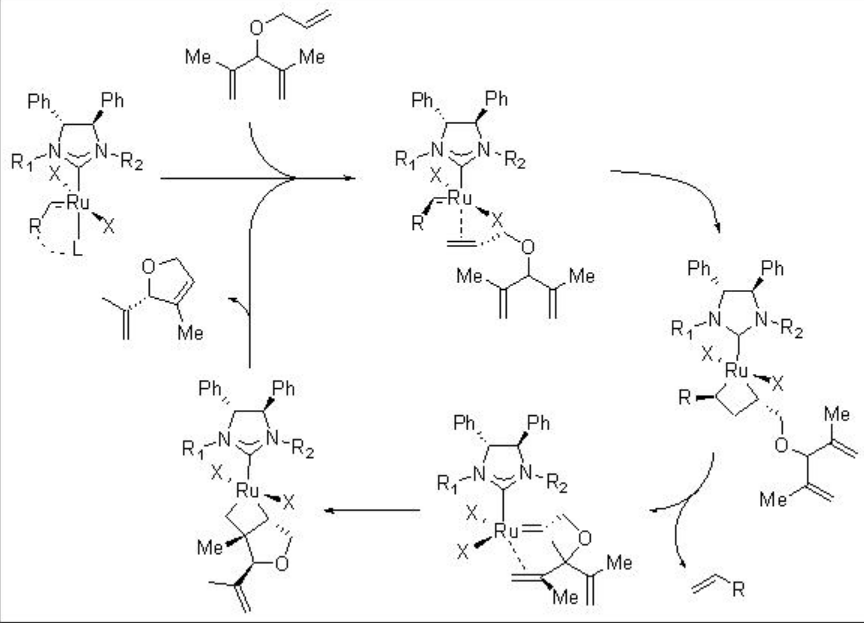
El mecanismo de la RCM catalizada por RU se describe en el Esquema\(\PageIndex{3}\). El inicio de la reacción puede tener lugar a través de la disociación del ligando de fosfina o del resto eterato quelatado. Posteriormente, el alqueno menos sustituido puede hacer coordinación con el centro Ru, lo que podría proceder a [2+2] -cicloadición, seguido de cicloreversión y formación de rutenaciclobutano que podría conducir al producto objetivo. La formación y escisión de los ciclobutanos son cruciales para la enantioselectividad de los productos.
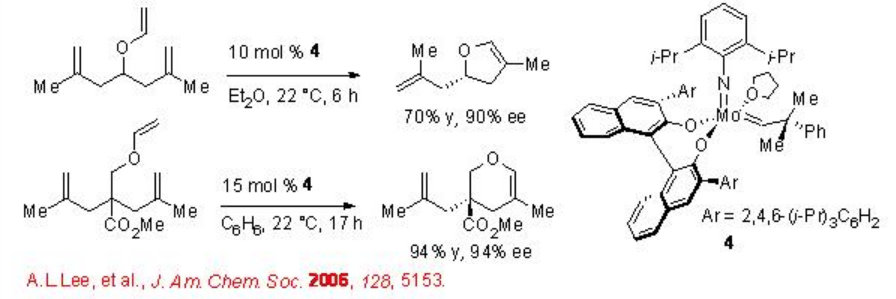
2.2.1.2 La síntesis de éteres de enol cíclicos usando RCM catalizado por Mo
Se encontró que la MCR basada en MO es exitosa para la síntesis de productos de furano y pirano con hasta 98% ee (Esquema\(\PageIndex{4}\)). Aunque se requiere una alta carga de catalizador, los productos pueden construirse con centros estereogénicos terciarios y cuaternarios. En contraste, los catalizadores basados en RU no son exitosos para esta transformación.
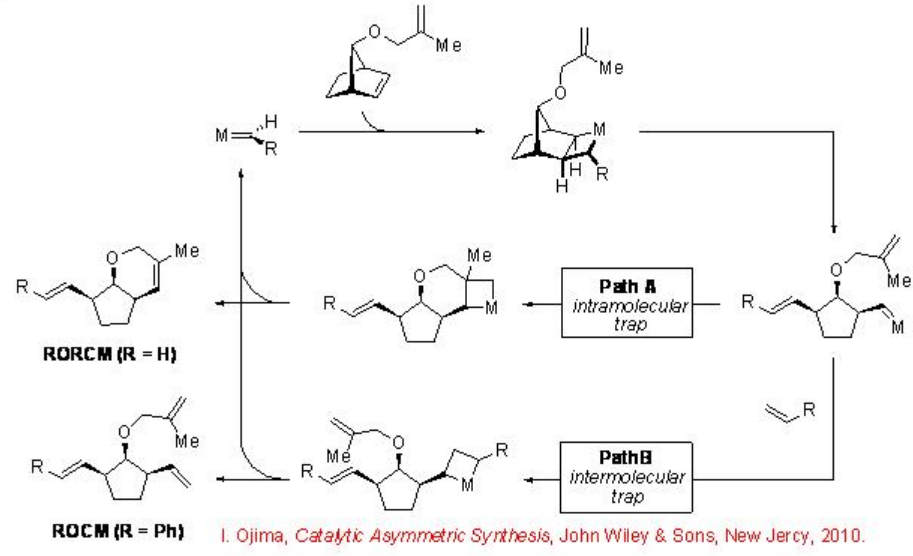
Metátesis de apertura/cierre de anillo (RORCM) y metátesis de apertura de anillo/cruz (ROCM)
Después de la apertura del anillo, el intermedio de carbeno resultante puede ser atrapado intramolecularmente por un alqueno colgante (RORCM, Ruta A) o intermolecularmente usando un compañero cruzado (ROCM, Ruta B) (Esquema\(\PageIndex{5}\)). Estas vías de reacción pueden controlarse mediante la selección del catalizador apropiado y la pareja cruzada, lo que puede conducir a una amplia gama de productos enantioméricamente enriquecidos a partir del material de partida común. En ausencia de trampa intramolecular (proceso ROCM), se puede generar una serie de mezclas complejas de productos.
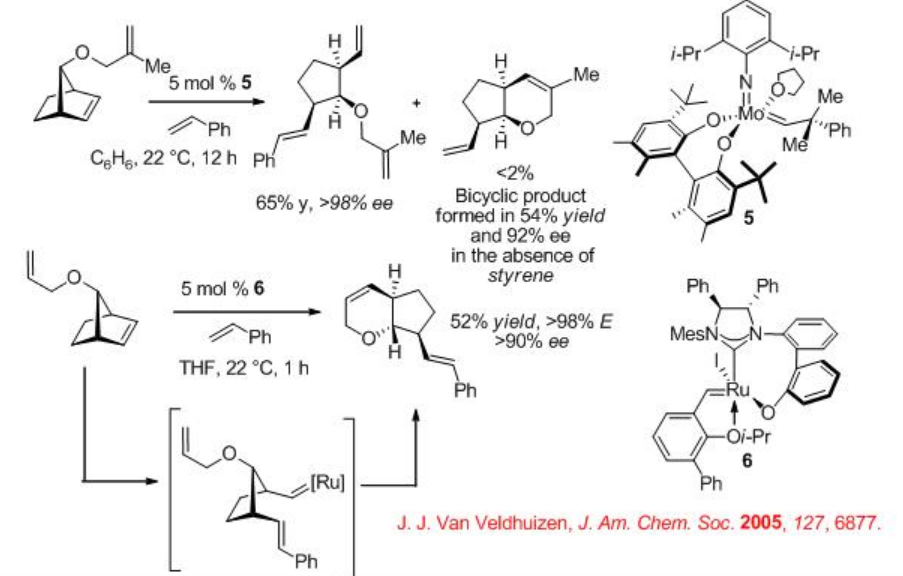
El esquema\(\PageIndex{6}\) presenta ejemplos para los procesos ROCM enantioselectivos catalizados por Mo y RU. Los norbornenos reaccionan con estireno vía ROCM con altas enantioselectividades. En ambos casos se generan E-alquenos. En ausencia de estireno, en el caso del sistema basado en MO, el producto RORCM se forma con 92% ee. El sustrato utilizado para el proceso ROCM catalizado por RU, procede la polimerización en presencia de Mo-catalizador en lugar del proceso ROCM.
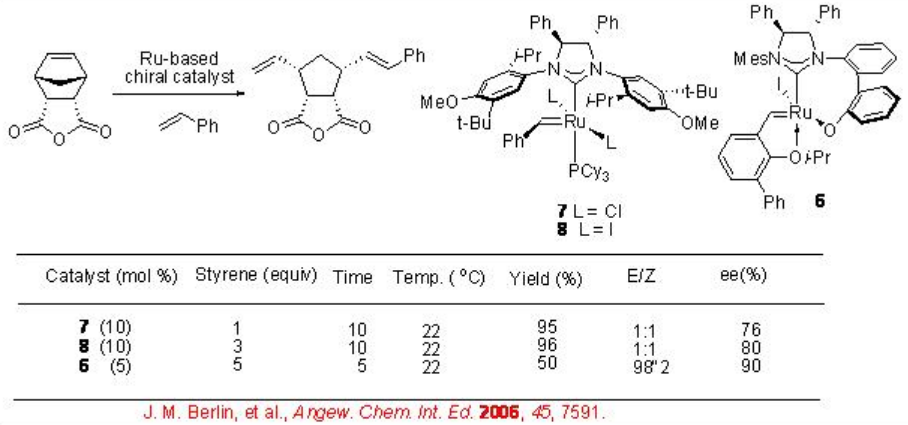
El esquema\(\PageIndex{7}\) muestra la comparación del ROCM catalizado por RU de norbornenos. Los catalizadores 7 y 8 que llevan ligandos NHC monodendados exhiben mayor reactividad (es decir, menor carga de catalizador) en comparación con el ligando NHC bidendado que porta complejo 6. Pero los sistemas que utilizan 7 y 8 producen poca selectividad E/Z, mientras que la reacción que usa 6 da exclusivamente el isómero E.
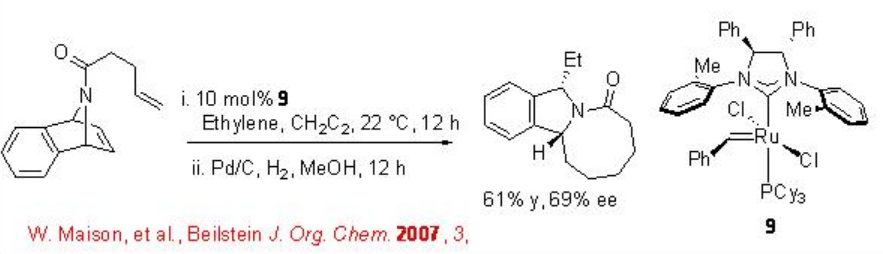
La síntesis de isoindol se ha mostrado recientemente usando RORCM quiral catalizado por RU con enantioselectividad moderada (Esquema\(\PageIndex{8}\)). En esta reacción el uso de etileno es para facilitar la liberación del catalizador. El producto de metátesis directa de alqueno es inestable y por lo tanto se aisló después de la hidrogenación.
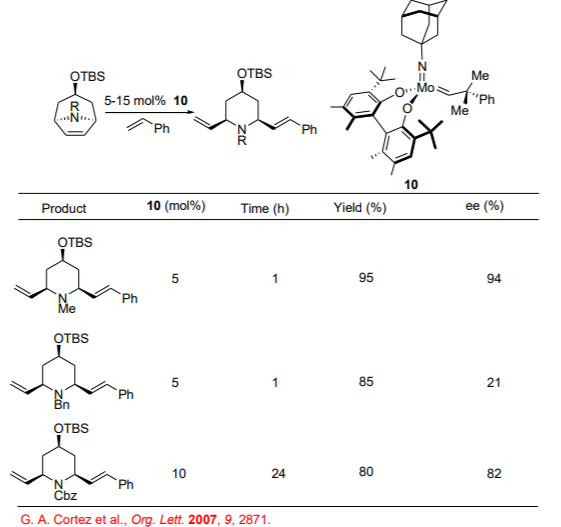
Las piperidinas 2,6-disustituidas son importantes unidades estructurales presentes en compuestos medicinalmente significativos. Usando las reacciones ROCM enantioselectivas basadas en MO, la síntesis de las piperidinas 2,6-sustituidas N-protegidas se puede lograr a partir de meso-azabicíclos con enantioselectividades moderadas a altas (Esquema\(\PageIndex{9}\)).
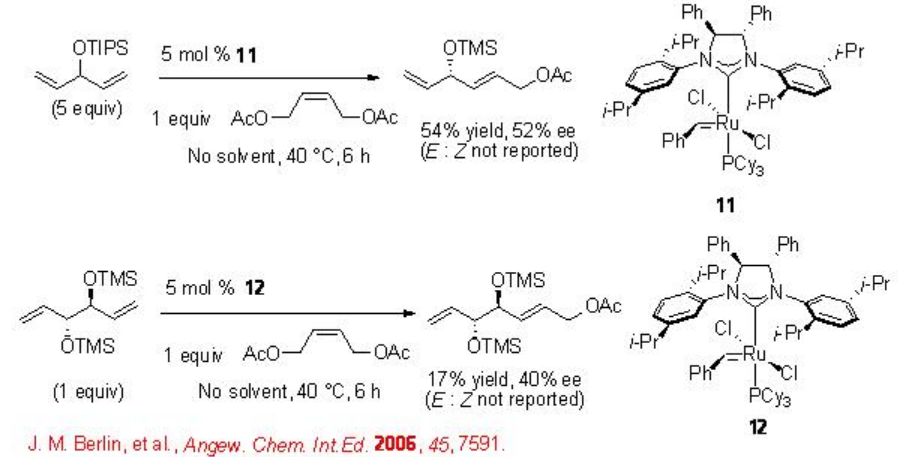
Metátesis cruzada (CM)
La CM enantioselectiva catalítica está menos desarrollada en las reacciones enantioselectivas de metátesis de alquenos. A diferencia de las metatesias de cierre de anillo y apertura de anillo que son impulsadas termodinámicamente, hay una fuerza impulsora mínima para el CM. Además, la selectividad entre dos parejas cruzadas diferentes conduce a complejos. Esquema\(\PageIndex{10}\) presenta algunos ejemplos de CM usando complejos quirales de Ru con enantioselectividad moderada. Estos sustratos no proceden RCM debido a la tensión del anillo de los productos.