2.5: Sustitución alílica con Nucleófilos de Carbono
- Page ID
- 73397
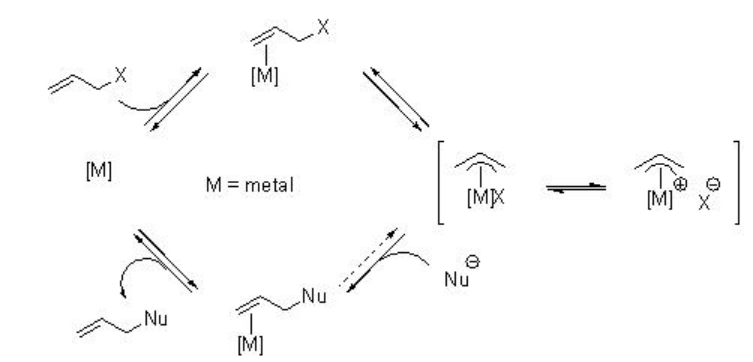
La sustitución alílica catalizada por metal es uno de los procesos más importantes en la síntesis orgánica. El Esquema 1 representa el ciclo catalítico de una reacción de sustitución alílica basada en metal de transición. La reacción comienza con la coordinación del complejo de metal de baja valencia con el doble enlace de un sistema alílico. La posterior adición oxidativa por eliminación del grupo eliminable X da como intermedio un complejo π -alilo. El intermedio podría ser una especie neutra o catiónica, dependiendo de la naturaleza de los ligandos y el contra-ión X. El nucleófilo típicamente se agrega al carbono terminal con inversión de configuración en lugar de a través del catión metálico con retención (Esquema\(\PageIndex{1}\)).
Reacciones catalizadas por paladio
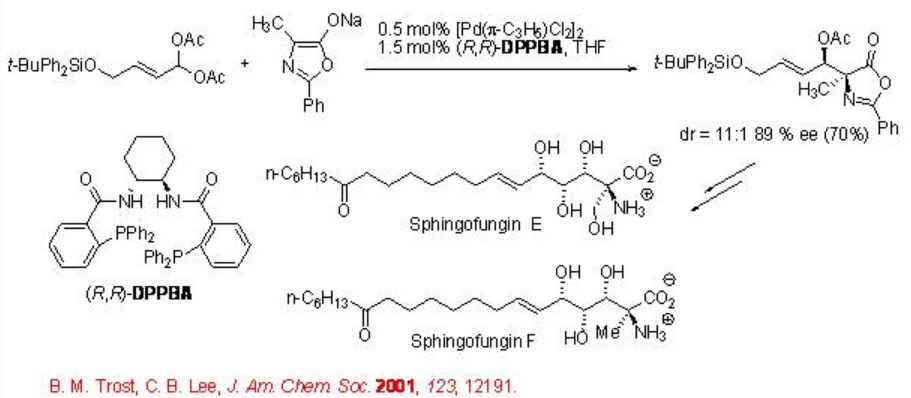
La reacción de sustitución alílica catalizada por paladio es un proceso muy potente. Esta sección cubre algunos ejemplos recientes sobre la sustitución alílica enantioselectiva catalizada por paladio con nucleófilos de carbono. El uso de azlactonas como pronucleófilo suave estabilizado es particularmente importante porque dan lugar a aminoácidos como productos. Scheme\(\PageIndex{2}\) presenta la síntesis de espingofunginas de Trost a través de la alquilación de un diacetato geminal con una azlactona. El producto se forma con buena diastereo- y enantioselectividad.
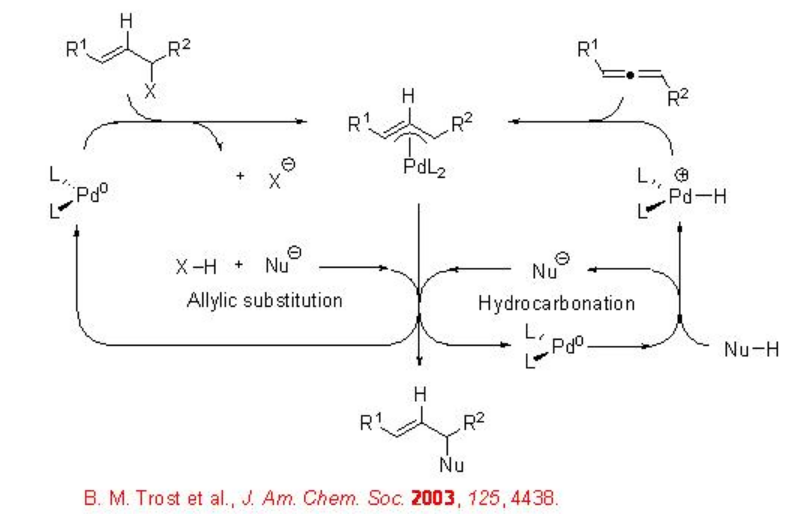
Se ha demostrado el método económico de átomos para obtener intermedios de (π -alil) Pd a partir de alenos mediante la adición de complejos hidrido-PD (Esquema\(\PageIndex{3}\)). Este método proporciona los mismos productos que los de la alquilación estándar de sustratos alílicos. Los pronucleófilos son suficientemente ácidos para producir especies de hPDL 2 (Esquema\(\PageIndex{4}\)).
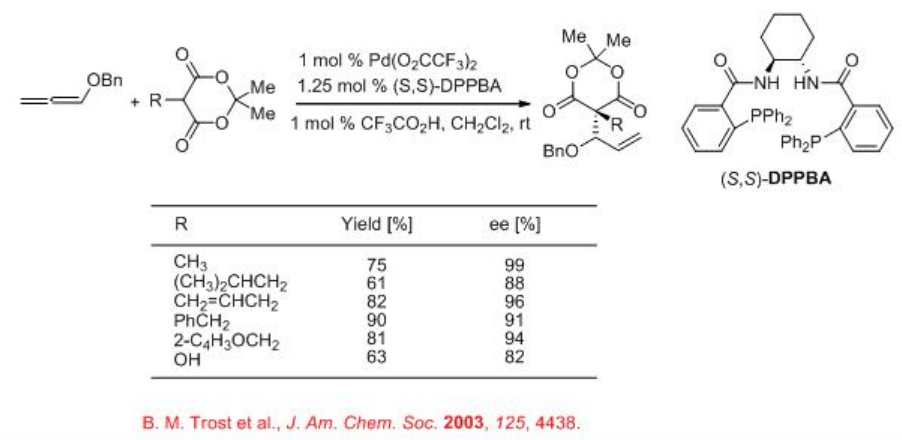
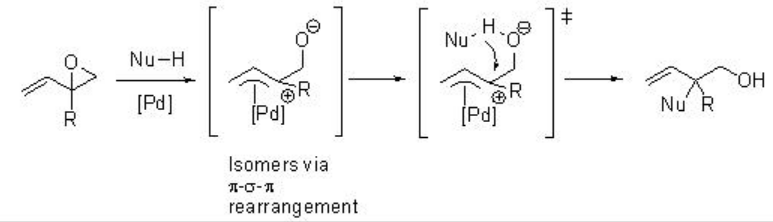
La reacción catalizada por paladio del vinil epóxido con nucleófilos proporciona productos ramificados (Esquema\(\PageIndex{5}\)). Esto se debe a la interacción del nucleófilo con un resto alcoxi u OH producido por reacción con la especie Pd (0). Por ejemplo, la reacción del monoepóxido de isopreno con β-ceto-ésteres da preferentemente los productos de alquilación ramificados en forma de hemiacetales (Esquema\(\PageIndex{6}\)). La naturaleza del β-cetoéster y la optimización de las condiciones de reacción son cruciales para el éxito de este proceso.
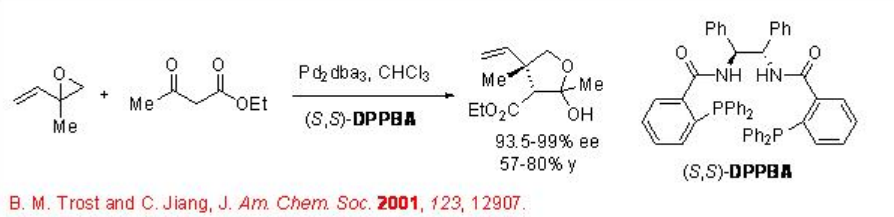
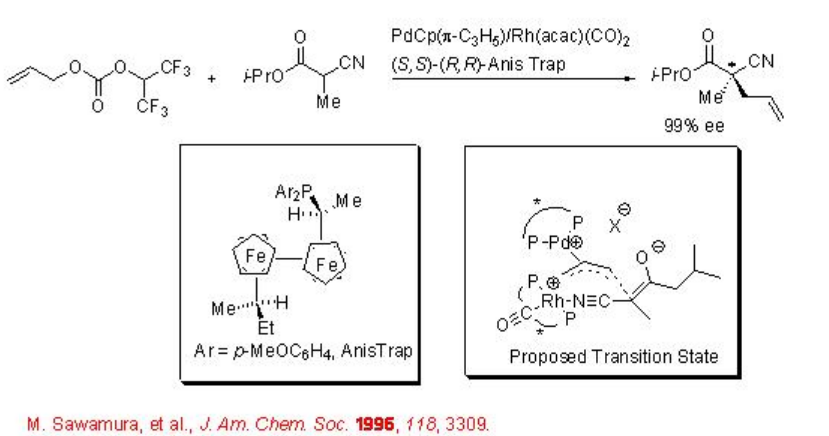
Sistema bimetálico que tiene Rh (acac) (CO) 2, Pd (Cp) (π -C 3 H 5) y el ligando Anis Trap se ha utilizado para la alquilación alílica con derivado del ácido α-cianopropiónico como pronucleófilo (Esquema\(\PageIndex{7}\)). Se cree que el control de la estereoquímica se realiza a través del nucleófilo con un complejo quiral Rh que se coordina con el grupo ciano.
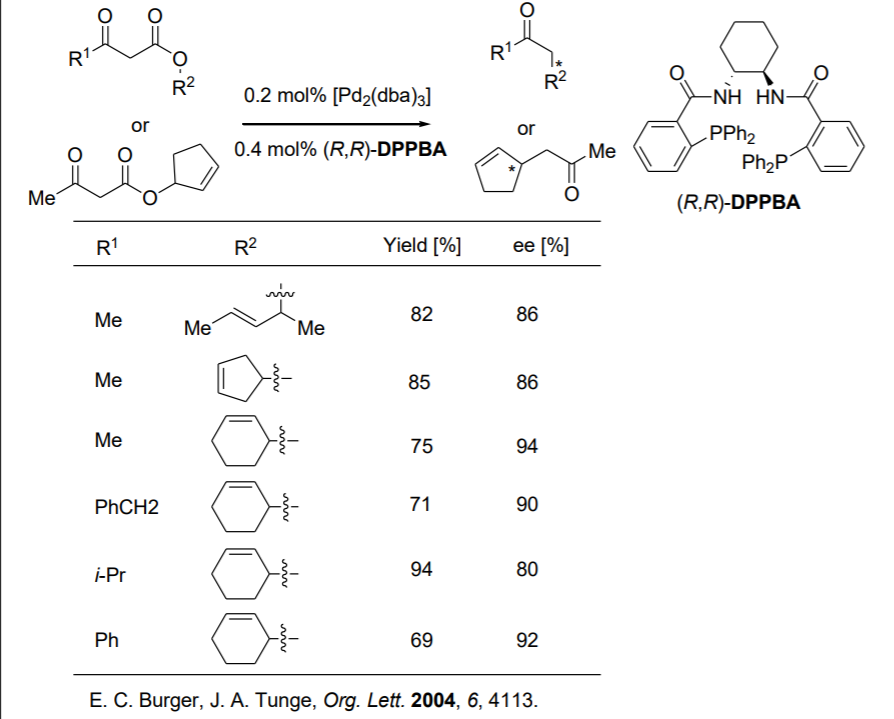
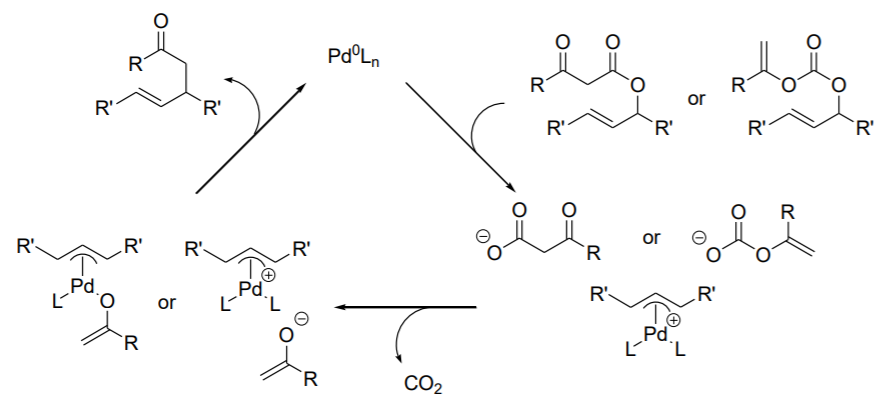
Recientemente, la alquilación alílica se ha realizado mediante enolato generado in situ por descarboxilación (Esquema\(\PageIndex{8}\)). Tanto los β-cetocarboxilatos alílicos como los enolcarbonatos alílicos se someten a una fácil descarboxilación después de la adición oxidativa de una especie de Pd (0) (Esquema\(\PageIndex{9}\)).
Reacciones Catalizadas por Níquel
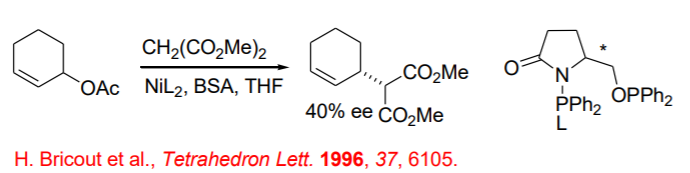
En comparación con las reacciones catalizadas por paladio, la química basada en níquel es menos explorada. Además, la química a base de níquel menos popular con las reacciones de nucleófilos blandos y pocos ejemplos sólo hasta el momento investigó. Por ejemplo, se ha estudiado la reacción de acetatos alílicos con nucleófilos blandos como el malonato de dimetilo utilizando una amplia gama de ligandos de fosfina (Esquema\(\PageIndex{10}\)). Los sustratos alílicos lineales dan una mezcla de regioisómeros, mientras que en el acetato de ciclohexenilo, la regioselectividad no juega ningún papel proporcionando el producto alquilado con enantioselectividad moderada en presencia de fosfina quiral L1.
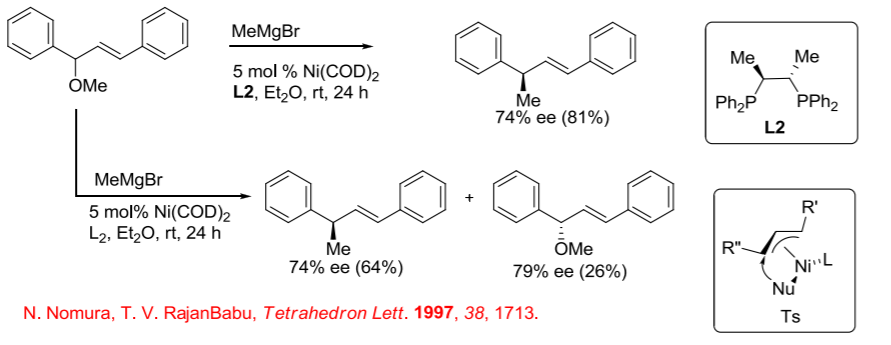
Sin embargo, los sistemas basados en níquel son muy populares con las reacciones de nucleófilos duros como ácidos borónicos, boratos y reactivos de Grignard. Por ejemplo, la reacción de éteres alílicos 1,3-disustituidos con reactivos de Grignard se puede lograr usando complejo de niquel fosfina con buena enantioselectividad (Esquema\(\PageIndex{11}\)). La reacción del éter metílico dio mejores resultados en comparación con los éteres fenílicos. En esta reacción, si la reacción se apaga antes del consumo completo del material de partida, se observa una resolución cinética significativa.
Reacciones catalizadas por molibdeno
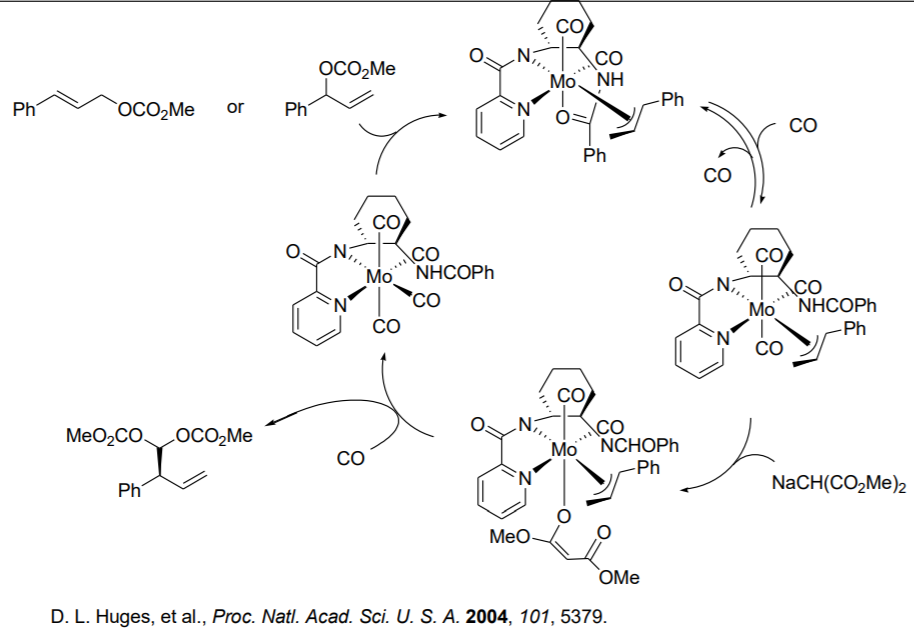
Aunque los sistemas catalizados por paladio dominan en la química π-alyl, las reacciones análogas catalizadas por MO también han surgido como reacciones poderosas en la síntesis orgánica. Las reacciones basadas en MO son las primeras que mostraron diferente regioselectividad en comparación con los sistemas catalizados con paladio. El esquema\(\PageIndex{12}\) ilustra el mecanismo para la alquilación alílica asimétrica catalizada por Mo.
Reacciones Catalizadas por Cobre
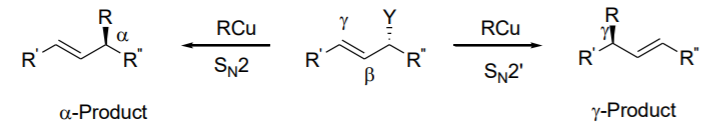
En el caso de los sustratos alílicos asimétricos, las reacciones de alquilación alílica catalizadas por paladio muestran mala regioselectividad. En este contexto, la química basada en el cobre es una alternativa interesante y se han realizado muchos esfuerzos sobre este tema durante los últimos años. Los sistemas basados en cobre toleran una amplia gama de nucleófilos duros y no estabilizados. Esquema\(\PageIndex{13}\) presenta la regioselectividad en reacciones de alilación catalizadas por cobre. En sustratos asimétricos, el nucleófilo puede atacar directamente en el grupo lábil (SN2) o en la posición alílica (SN2') bajo migración del doble enlace dependiendo de los parámetros de reacción, así como del sustrato y nucleófilo.
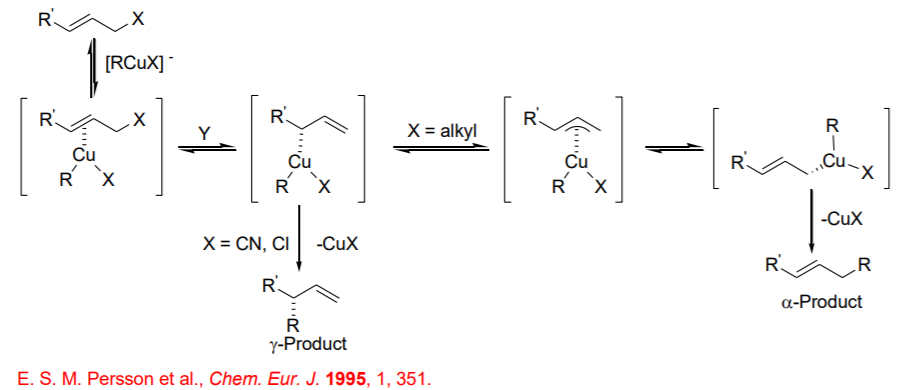
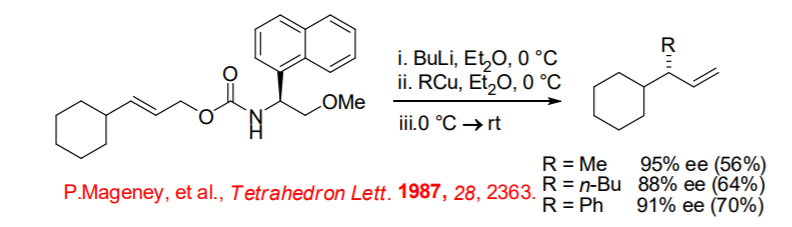
Los resultados observados sugieren que la regioselectividad y estereoselectividad se establecen en diferentes etapas (Esquema\(\PageIndex{14}\)). Por ejemplo, la reacción de carbamatos quirales con reactivo de cobre aquiral da producto SN2' con excelente enantioselectividad (Esquema\(\PageIndex{15}\)).