2.4: Reacciones de adición de conjugado asimétrico catalizadas por metal
- Page ID
- 73408
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La adición de conjugados asimétricos es una de las herramientas poderosas para la construcción de enlaces carbono-carbono y carbono-heteroátomo en la síntesis orgánica. Esta reacción encuentra extensas aplicaciones para la construcción de esqueletos de carbono enantioenriquecidos para la síntesis total de numerosos compuestos biológicamente activos. A veces es posible construir múltiples estereocentros en una sola operación sintética. Esta conferencia cubre algunos ejemplos de los desarrollos recientes en la adición conjugada de reactivos de Grignard, organozinc, organolitio, organocobre y organoborano con alquenos activados en presencia de ligando quiral o catalizadores quirales.
Reacciones de los reactivos Grignard
La adición conjugada de reactivos de Grignard con alquenos activados electrofílicamente está bien explorada. Algunos de los ligandos quirales desarrollados para las reacciones de adición conjugada de reactivos de Grignard con compuestos de carbonilo α, β -insaturados se muestran en el Esquema\(\PageIndex{1}\).
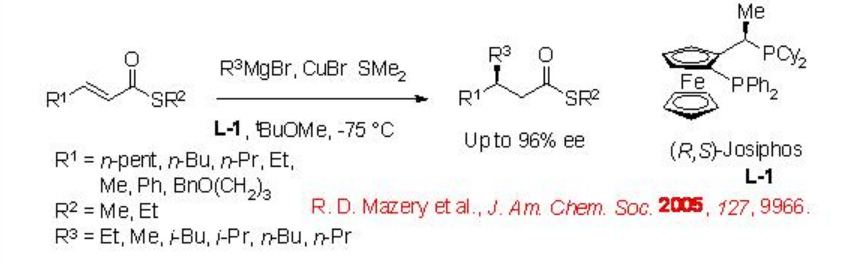
Uno de los ejemplos recientes es la adición de bromuro de alquil magnesio a tioésteres α, β -insaturados usando el ligando L-1 de Josiphos (Esquema\(\PageIndex{2}\)). Las reacciones de una serie de ejemplos se pueden lograr con hasta 96% de enantioselectividad.
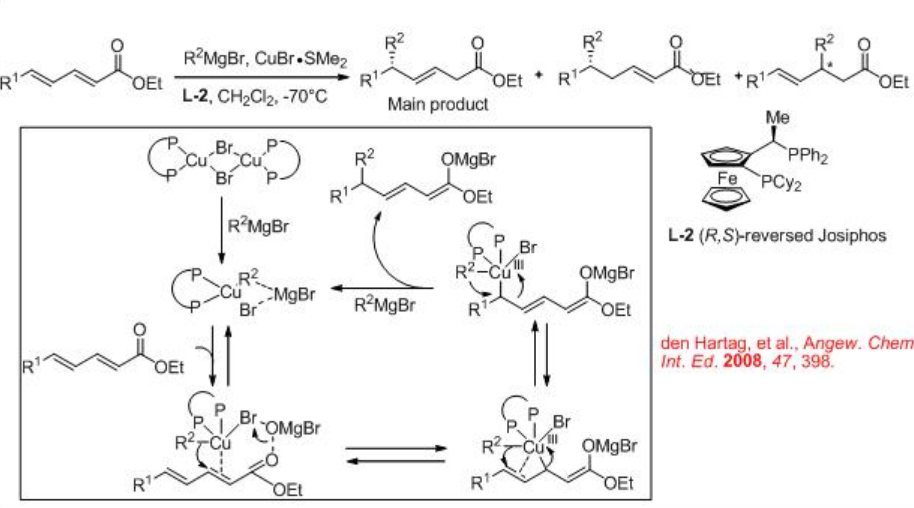
En comparación con la reacción de adición de 1,4-conjugado, las reacciones con aceptores Michael extendidos necesitan un control adicional de la regioselectividad. Por ejemplo, utilizando el ligando L-2 de Josiphos invertido (R, S), se ha desarrollado la adición conjugada 1,6-asimétrica a ésteres insaturados α, β, γ, δ (Esquema\(\PageIndex{3}\)).
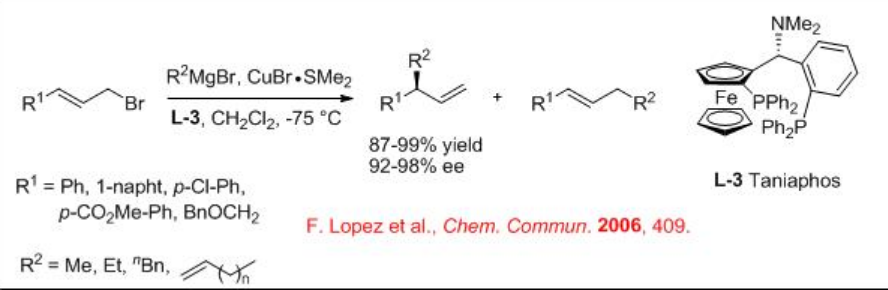
Además de los ligandos ferrocenilo L1-2, el taniafos L-3 con CubR∙SME 2 también es altamente efectivo para la adición conjugada de electrófilos alílicos con reactivos de Grignard (Esquema\(\PageIndex{4}\)). En esta reacción, se ha encontrado que los bromidos alílicos alifáticos son excelentes sustratos.
Reacciones de Reactivos Organocinc
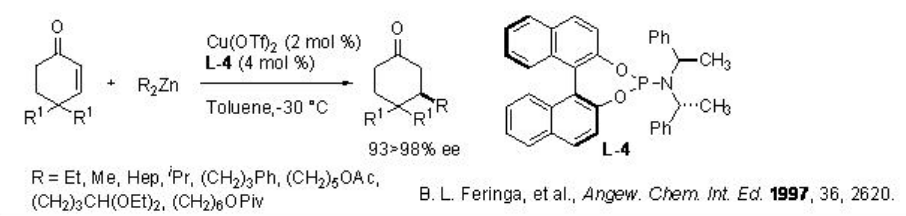
La adición conjugada asimétrica de dialquilzinc a compuestos proquirales α, β -insaturados es uno de los métodos poderosos para la formación de enlaces carbono-carbono en la síntesis orgánica. Se ha prestado mucha atención al desarrollo de nuevos ligandos para esta reacción. Se ha encontrado que el ligando de fosforamidita de BINOL L-4 es efectivo para la adición de conjugados a sustratos cíclicos con hasta 98% ee (Esquema\(\PageIndex{5}\)).
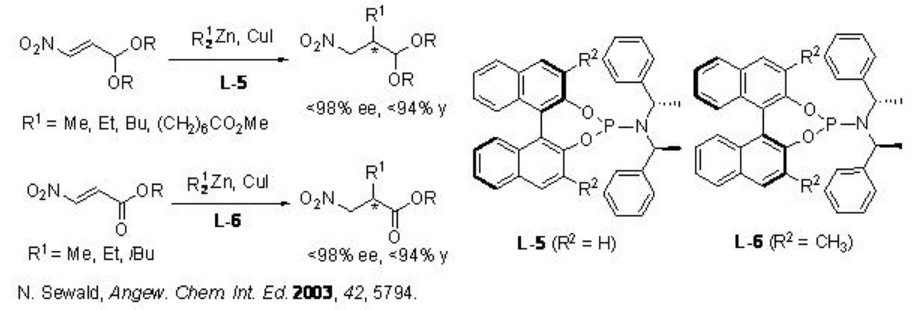
Posteriormente, se ha demostrado la adición enantioselectiva catalizada por cobre (I) de dialquilzinc a derivados de 3-nitroacroleína utilizando ligandos de fosforamidita L-5 y L-6 con hasta 98% ee (Esquema\(\PageIndex{6}\)).
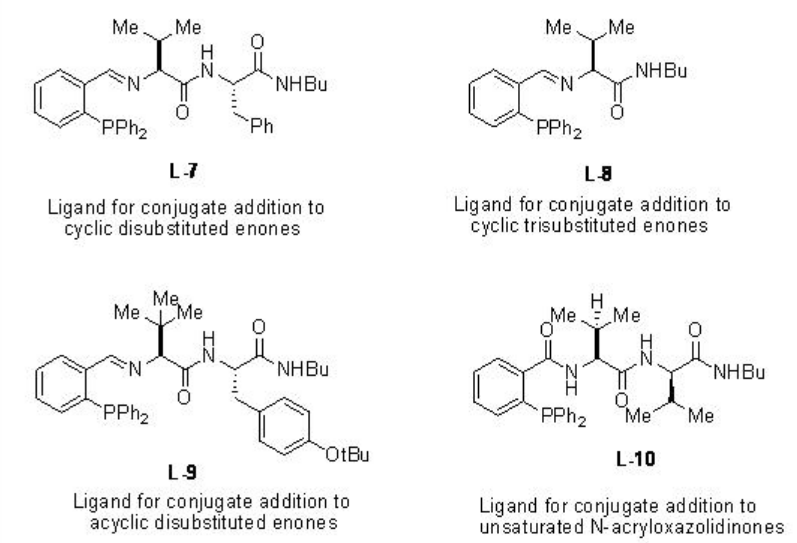
Esquema\(\PageIndex{7}\) resume algunos de los ligandos basados en péptidos para la adición de dialquilzinc a compuestos α, β -insaturados. Por ejemplo, la adición conjugada catalizada por cobre de reactivos de dialquilzinc a cetonas alifáticas acíclicas α, β -insaturadas procede en presencia de L-9 con hasta 94% ee, mientras que la reacción usando L-10 da hasta 98% ee (Esquema\(\PageIndex{8}\)).
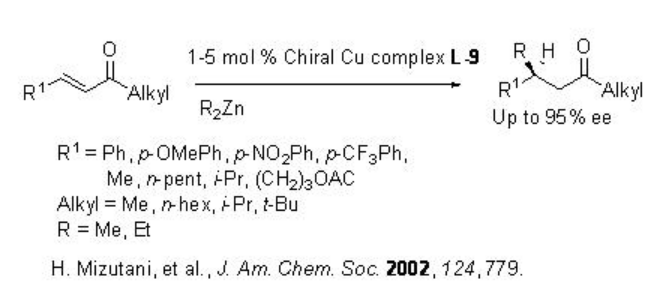

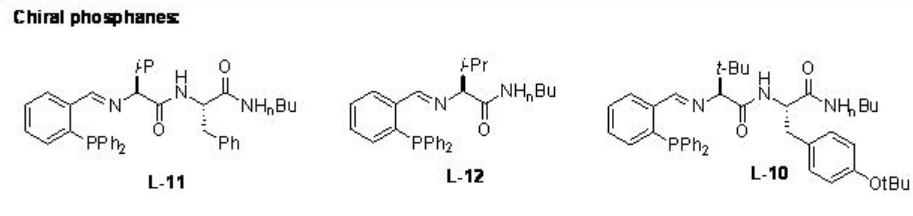
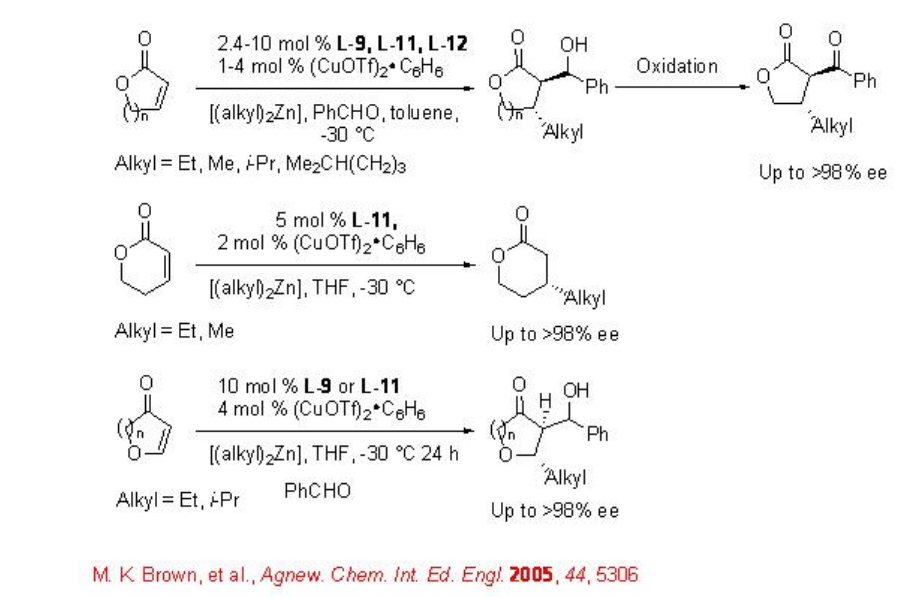
Posteriormente, se han estudiado los ligandos quirales L-10 a L-12 para las reacciones de reactivos dialquilzínicos a enonas heterocíclicas como furanonas, piranonas y sus derivados (Esquema\(\PageIndex{9}\) -\(\PageIndex{10}\)).
Reacciones de Reactivos de Organolitio
Los reactivos organolitio son especies altamente reactivas y sus reacciones de adición conjugada con compuestos de carbonilo α, β-insaturados son de gran interés. Uno de los ejemplos recientes es la reacción de organolitio configuracionalmente estable a compuestos de carbonilo cíclico α, β -insaturados usando (-) -esparteína que se puede realizar con alta enantioselectividad (Esquema\(\PageIndex{11}\)).
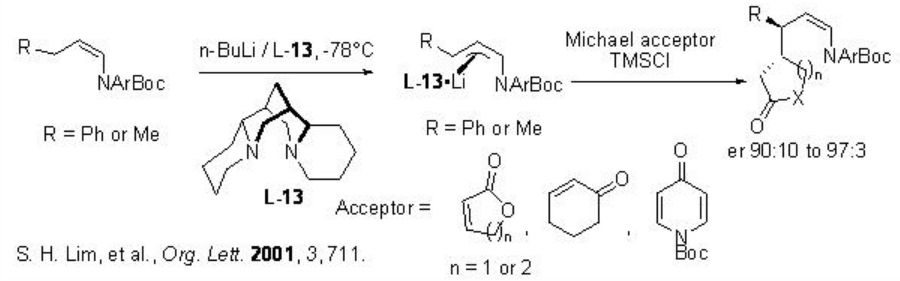
Reacciones de Organoboranes
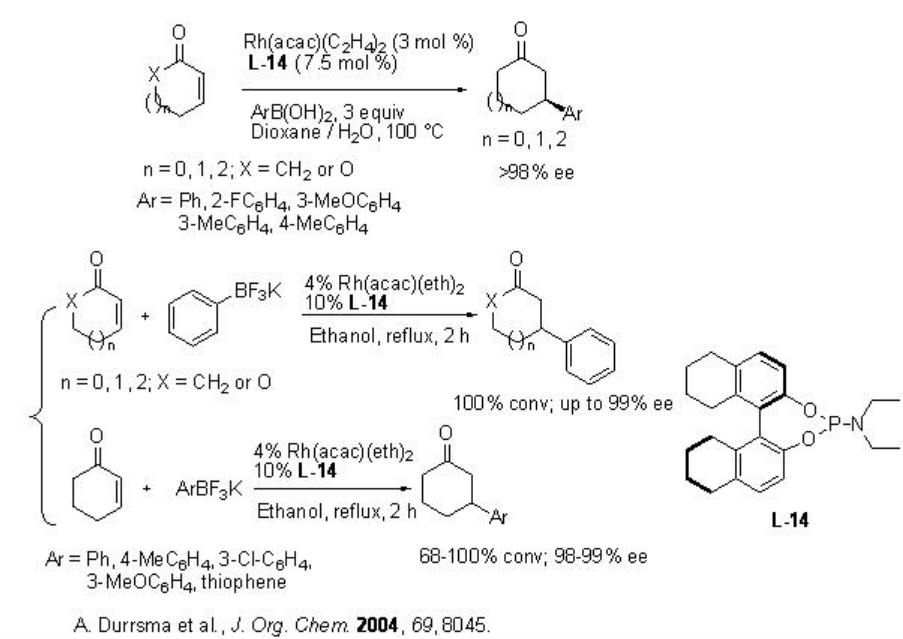
La adición conjugada asimétrica de organoboranos usando complejo quiral de rodio fosfina es un proceso exitoso. Por ejemplo, los ácidos arilborónico y alquenilborónico experimentan reacción con cetonas cíclicas y acíclicas α, β -insaturadas en presencia de complejo quiral de rodio portador de (S) -BINAP con alta enantioselectividad (Esquema\(\PageIndex{12}\)). La reacción procede a través de los intermedios fenilrodio, oxa-π -alilrodio e hidroxorodio (Esquema\(\PageIndex{13}\)).
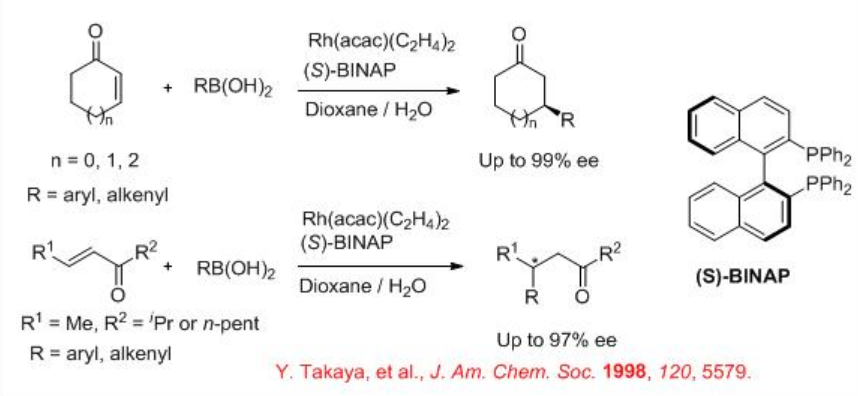
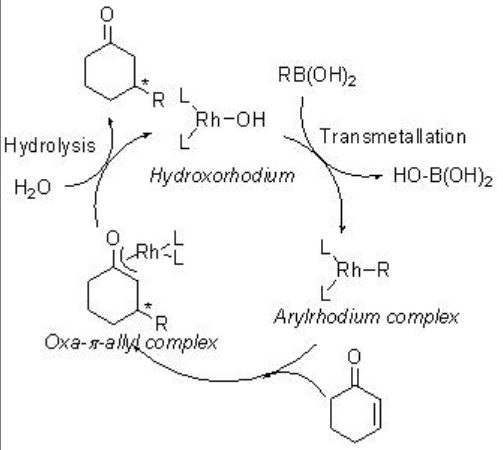
Además de las bifosfinas quirales, los dienos quirales y los ligandos de fosforamidita quiral también son efectivos para la adición conjugada catalizada por rodio de organoboranos. Por ejemplo, la adición conjugada catalizada por rodio de ácidos borónicos y trifluoroboratos de potasio a las enonas ocurre con alta enantioselectividad (Esquema\(\PageIndex{14}\)).