3.1: Reacciones con Carbenoide Metálico
- Page ID
- 73331
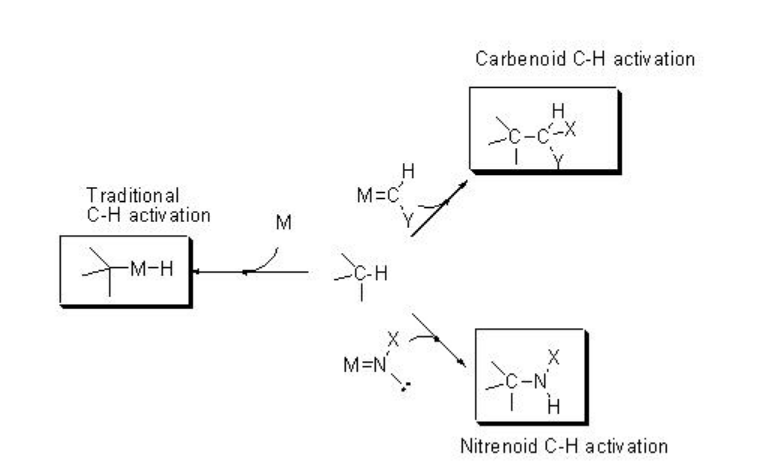
La funcionalización de los enlaces C-H constituye un enfoque atractivo para la síntesis directa de moléculas orgánicas complejas como productos farmacéuticos, productos naturales y otras dianas industrialmente relevantes. Así, se ha dedicado mucho esfuerzo para lograr métodos prácticos, catalíticos y selectivos para la funcionalización C-H. El esquema\(\PageIndex{1}\) presenta las dos direcciones principales evolucionadas para el proceso de funcionalización C-H: (i) activación directa de C-H que implica la adición oxidativa al enlace C-H sobre un centro metálico activo, y (ii) inserción de carbenos o nitrenos coordinados con metal de transición en el enlace C-H para dar funcionalización productos.
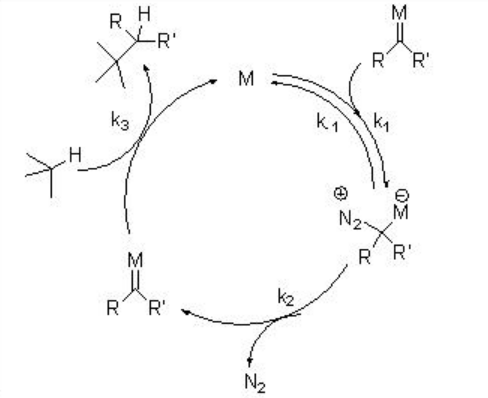
Carbenos metálicos generalmente producidos a partir de compuestos diazoicos por extrusión de nitrógeno catalizado por metal. Los precursores alternativos de carbeno incluyen iluros de yodonio, sulfonio, sulfoxonio, tiofenio y fosfonio, pero su aplicación sintética es menos explorada. El mecanismo general para la generación de carbeno a través de complejos de dirhodium se muestra en el Esquema\(\PageIndex{2}\). En presencia de un complejo metálico adecuado, el compuesto diazo puede coordinarse reversiblemente y someterse a extrusión de nitrógeno limitante de velocidad para dar un intermedio de carbenoide metálico reactivo. Este último reaccionará con un agente de atrapamiento adecuado presente en la mezcla de reacción.
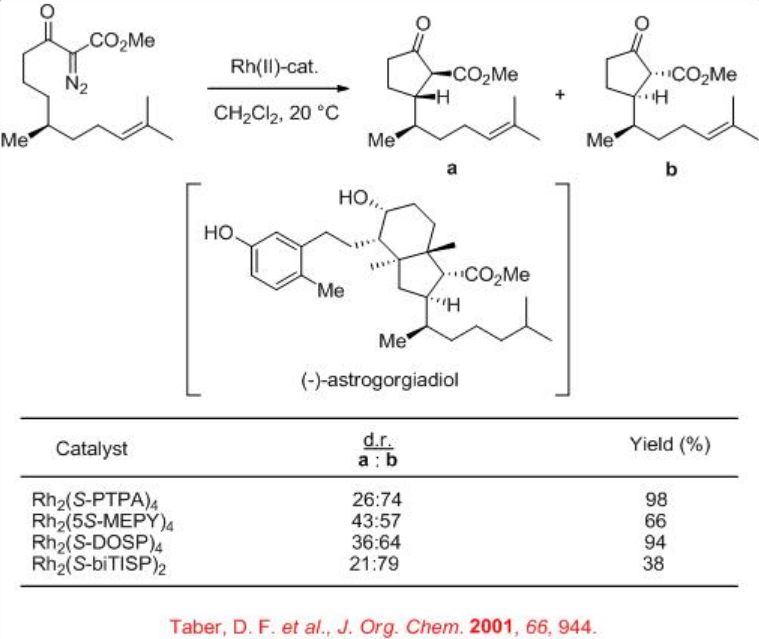
Por ejemplo, los complejos quirales de dirhodio catalizan la inserción intramolecular C-H de α -diazo - β -cetoéster para dar el intermedio para la síntesis total del secosteroide marino (-) -astrogorgiadiol (Esquema\(\PageIndex{3}\)). Hasta 58% de se observa con un rendimiento moderado de 38% empleando Rh 2 (S-BiTiSP) 2 como catalizador. La reacción usando Rh 2 (S-PTPA) 2 produjo un excelente rendimiento pero con menor diastereoselectividad.
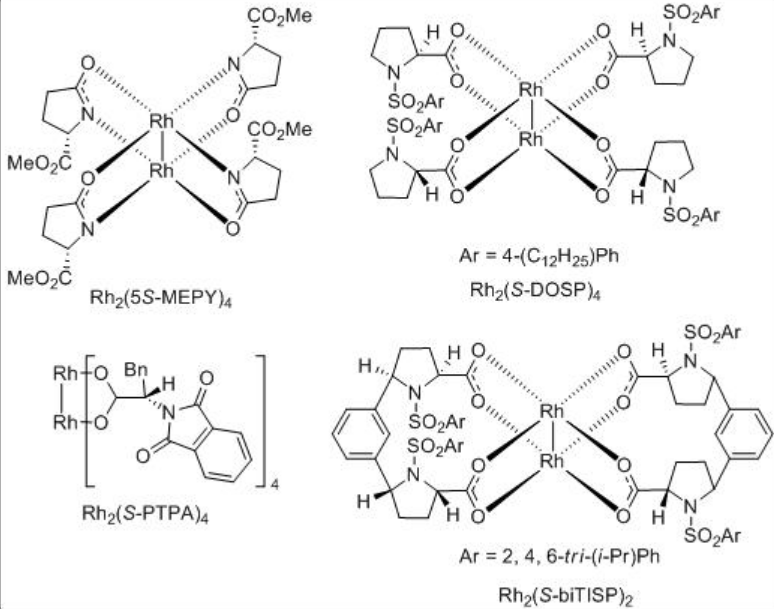
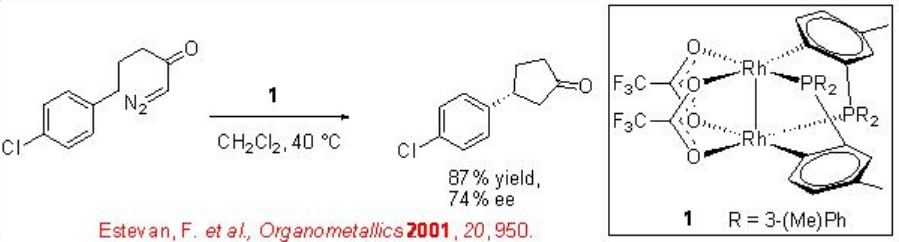
Se encontró que los complejos orto-metalados de arilfosfina dirhodium (II) son catalizadores efectivos para las inserciones intramoleculares C-H de ciertas diazocetonas (Esquema\(\PageIndex{4}\)). Uno de los ejemplos es el uso del complejo de dirhodio 1 para la reacción del sistema cloro-sustituido para proporcionar ciclofentanona en 74% ee y 87% de rendimiento. Este sistema funciona bien con la porción arilo que tiene un grupo aceptor de electrones.
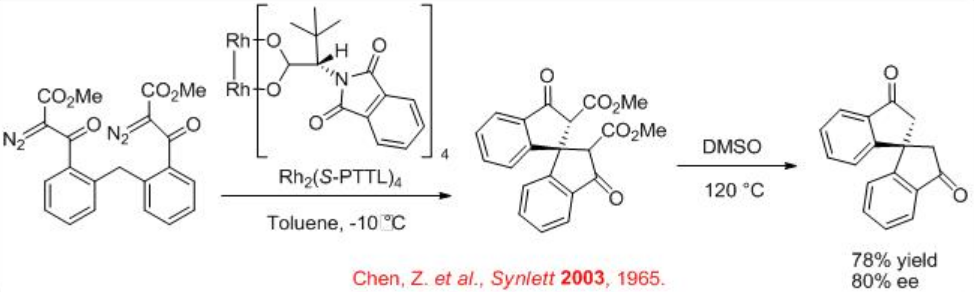
El esquema\(\PageIndex{5}\) ilustra un ejemplo para la formación estereocontrolada de estereocentro cuaternario usando el proceso de inserción de carbenoide C-H quiral catalizado por Rh 2 (S-PTTL) 4.
El sistema catalítico anterior también es efectivo para la desimetrización de diazo cetoésteres sustituidos con arilo (Esquema\(\PageIndex{6}\)). Esta reacción procede mediante sustitución aromática electrofílica y se han logrado números de recambio de hasta 98000.
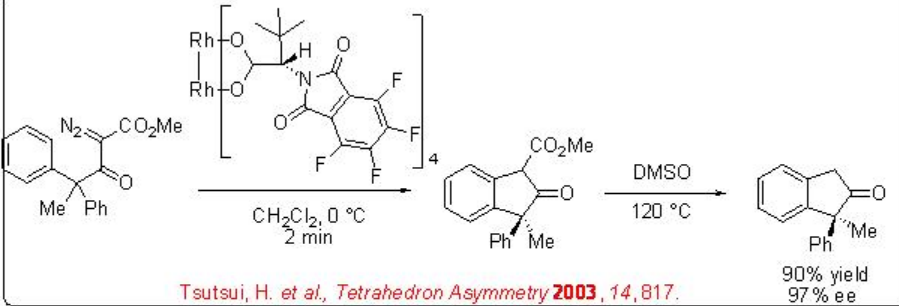
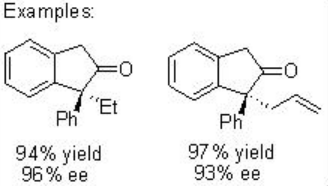
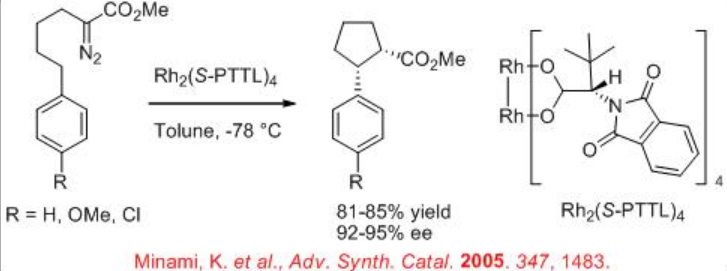
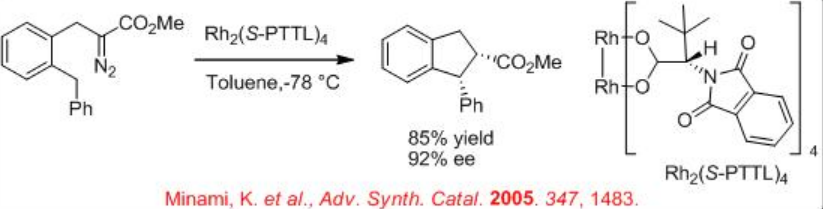
Además, la construcción de cis-ciclopentanonas a partir de diazoéster se puede lograr mediante inserción exclusiva (Esquema\(\PageIndex{7}\)). Además, la construcción de cis-indano disustituido se puede lograr con 85% de rendimiento y 92% ee (Esquema\(\PageIndex{8}\)). Estos ejemplos ilustran que la elección de las condiciones de reacción y los catalizadores para la transformación de carbenoides son cruciales para la selectividad.
Tanto los catalizadores de carboxamidato de primera generación (Rh 2 (MEOX) 4 y Rh 2 (MEPY) 4) como de segunda generación (Rh 2 (4S-MACIM) 4) muestran muy buen enantiocontrol para la reacción de desimetrización del diazoacetato de ciclohexilo (Esquema\(\PageIndex{9}\)). En términos de diastereoselectividad, esta última da los mejores resultados de 99:1 el cual se atribuye al sustituyente N que controla la orientación carbenoide.
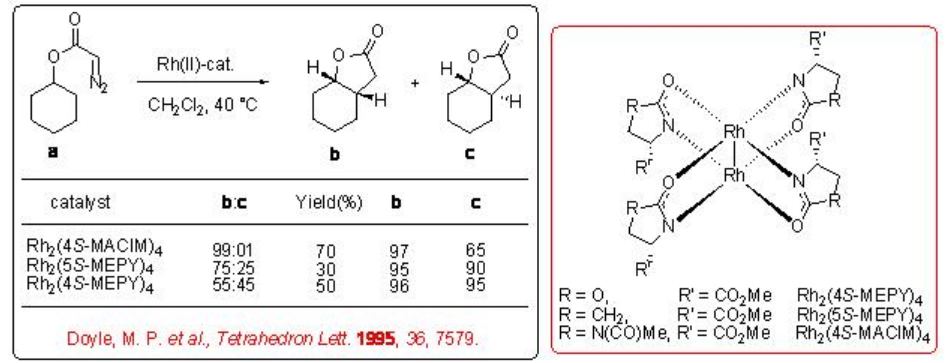
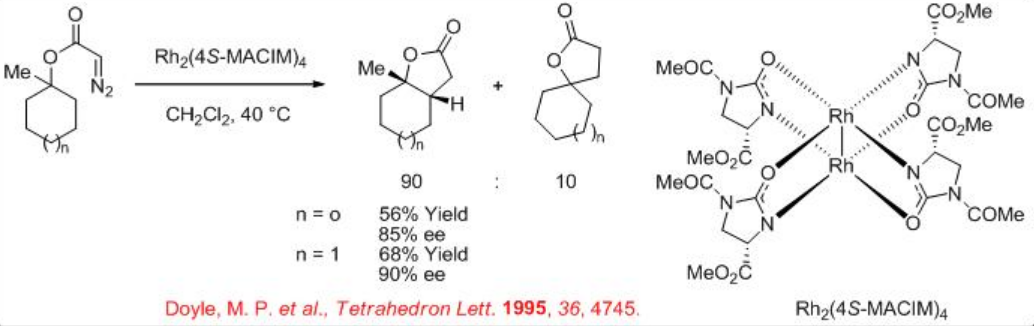
En el caso del diazoacetato de ciclohexilo que tiene el sistema terciario, se ha observado una mezcla de la inserción esperada en el grupo metileno e inserción en el grupo metilo en presencia de Rh 2 (4S-MACIM) 4 (Esquema\(\PageIndex{10}\)). El sistema de ciclopentano también proporciona resultados similares con un rendimiento y enantioselectividad algo menores.
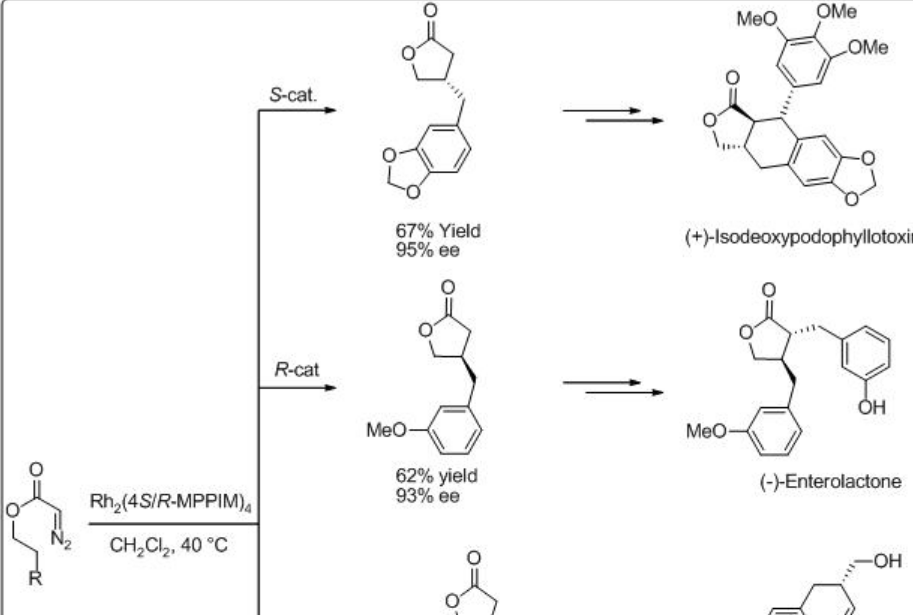
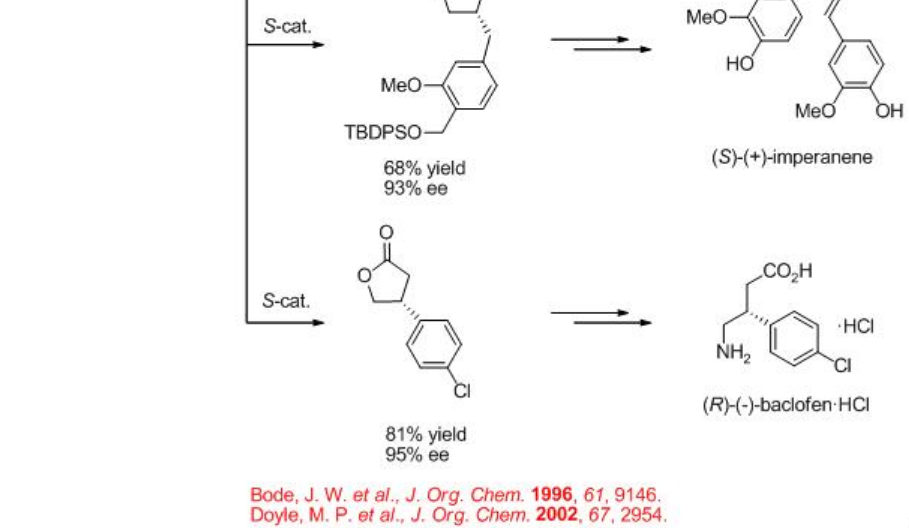
La construcción de γ -lactona se ha demostrado a través de la inserción intramolecular C-H de diazoacetatos que encuentran amplias aplicaciones en la síntesis de productos naturales y agentes farmacéuticos. Por ejemplo, la síntesis de (+) -isodesoxipodofilotoxina, (-) -enterolactona, (S) - (+) -imperaneno y (R) - (-) -baclofeno se han logrado con la formación de lactona como paso clave en presencia de Rh 2 (4S/R-MPPIM) 4 (Esquema\(\PageIndex{11}\)).
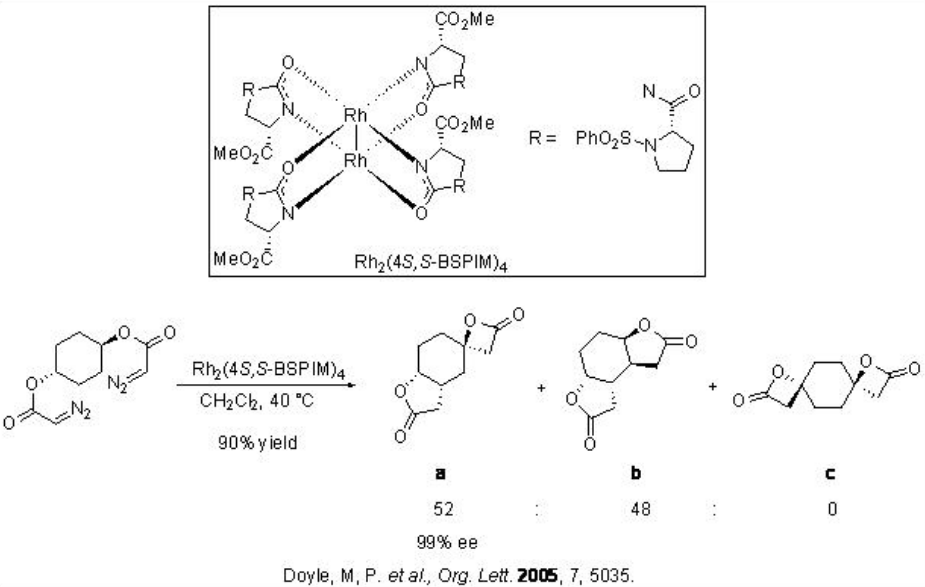
Las reacciones de inserción de carbenoides también se han utilizado para la amplificación de inducción asimétrica. Por ejemplo, se han realizado inserciones secuenciales intramoleculares de C-H sobre diazoacetato de meso - ciclohexilo (Esquema\(\PageIndex{12}\)). La formación de una mezcla 1:1 de a y b se observa usando Rh 2 (4 S, S-BSPIM) 4 con más de 90% de rendimiento y 99% de enantioselectividad.
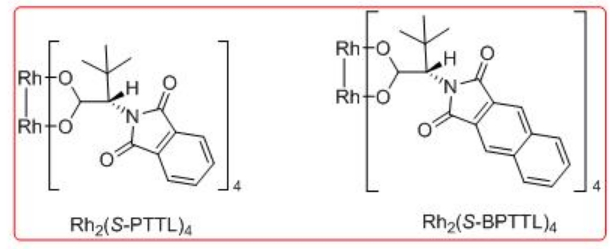
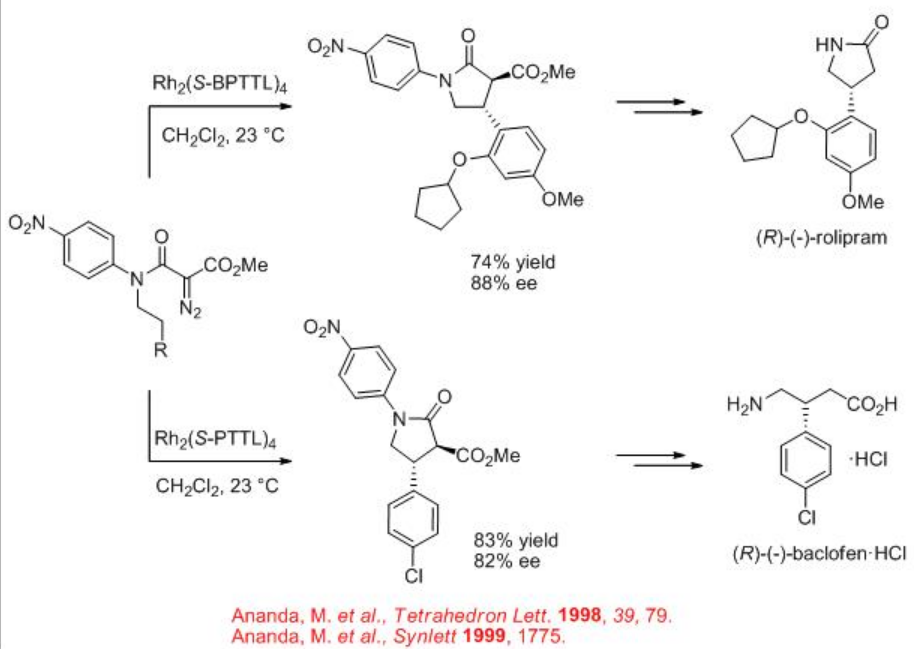
La aplicación sintética de la química de inserción de carbenoides C-H catalizada por dirhodio se ha demostrado como paso clave para la formación de γ -lactama controlada por sitio a la síntesis de (R) - (-) -baclofeno, agonista del receptor GABAB y (R) - (-) -rolipram (Esquema\(\PageIndex{13}\)). Se encuentra que Rh 2 (S-BPTTL) es el catalizador óptimo para la síntesis del intermedio para (R) - (-) -rolipram con 74% de rendimiento y 88% ee, mientras que Rh 2 (S-BPTTL) es efectivo para la síntesis del intermedio a (R) - (-) -baclofeno con 83% de rendimiento y 82% ee.
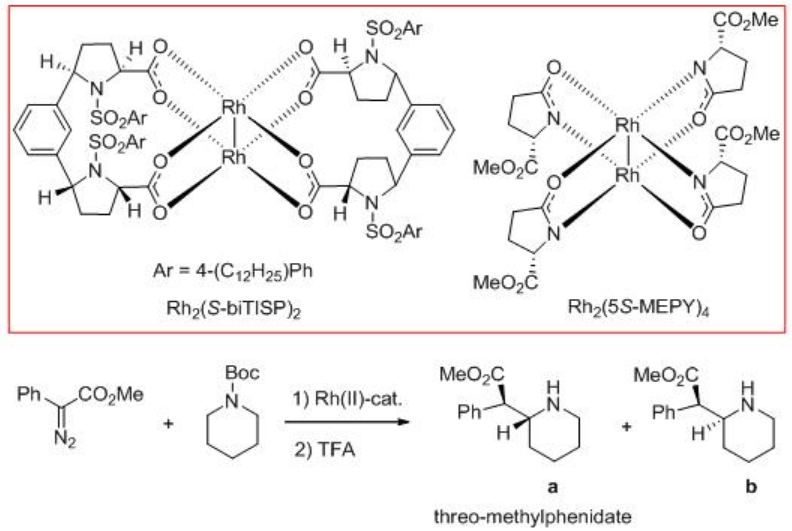
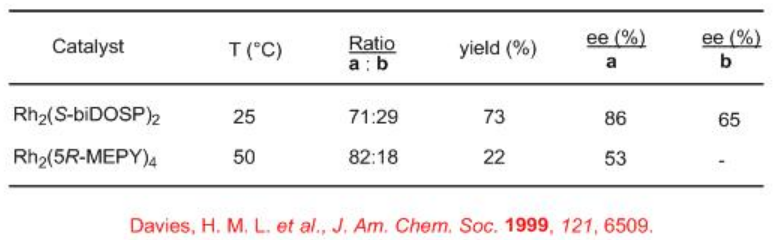
Hasta el momento hemos visto reacciones de inserción de C-H carbenoides intramoleculares. Recientemente se han explorado reacciones de inserción intermolecular de carbenoides C-H. El Esquema 6 ilustra la reacción N-Boc piperidina con metilfenildiazoacetato en presencia de Rh 2 (S-BiDoSP) 2 a temperatura ambiente. Se forman dos diastereómeros en una relación 71:29 con un rendimiento global de 73% y hasta 86% ee. El treo-metilfenidato racémico es actualmente un fármaco comercializado para el tratamiento del trastorno de hiperactividad de atención. Los heterociclos nitrogenados de siete y ocho miembros dan mayor selectividad. El uso de carboxamidato de dirhodio Rh 2 (5R-MEPY) 4 para esta química muestra una diastereoselectividad mejorada pero con bajo rendimiento y enantioselectividad.