4.6: Aziridinación de Alquenos
- Page ID
- 73214
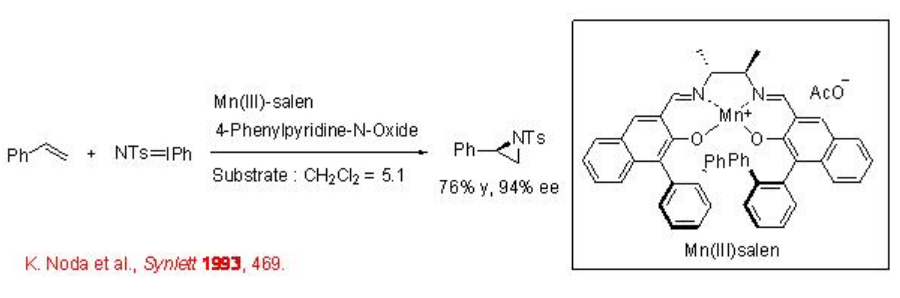
La aziridinación de alquenos se ha logrado exitosamente usando Mn-salen quiral con 94% ee. La presencia de cantidad catalítica de 4-fenilpiridina-N-óxido conduce a la potenciación de la enantioselectividad (Esquema\(\PageIndex{1}\)).
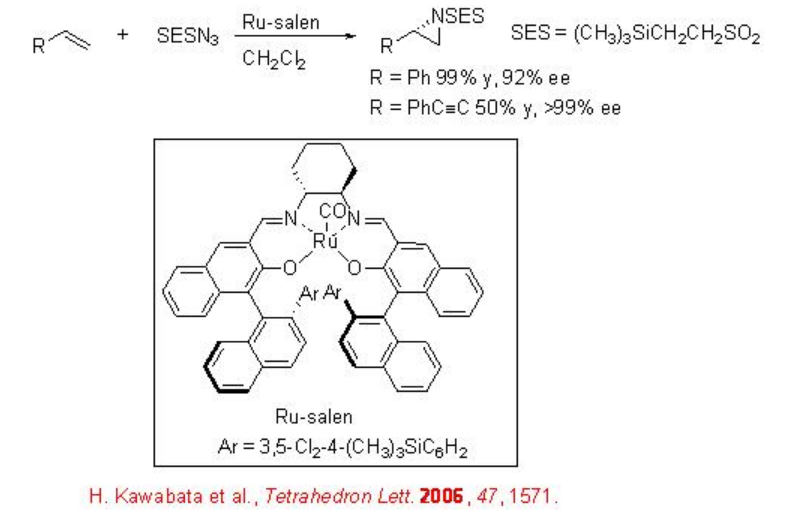
El Ru quiral (salen) (CO) puede ser utilizado para la aziridinación utilizando el grupo 2- (trimetilsilil) etanosulfonilo (SES) como precursor de nitreno, debido a que el grupo SES es un grupo N-protector fácilmente removible en condiciones más suaves (Esquema\(\PageIndex{2}\)). Estas condiciones de reacción son compatibles para las reacciones de alquenos conjugados con alta enantioselectividad.
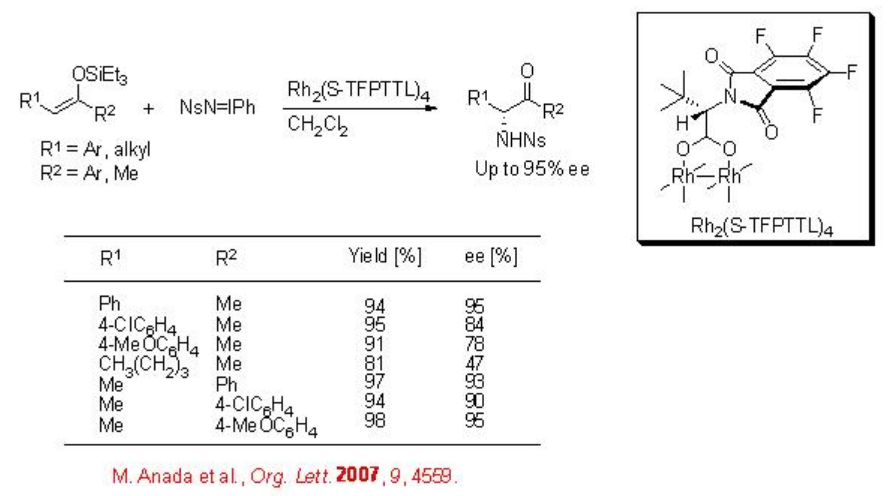
Aunque se ha explorado bien la aziridinación de alquenos, la reacción de los enoles sigue siendo esquiva. La aziridinación de enoles generalmente conduce a α -amino cetonas a través del proceso de apertura del anillo de los intermedios de aziridina. El complejo quiral de dirhodio, Rh 2 (S-TFPTTL) 4, cataliza eficientemente la aminación de éteres enólicos empleando NSn=iPh como fuente de nitrógeno (Esquema\(\PageIndex{3}\)). El uso del grupo N-2-nitrofenilsulfonilo (Ns) es sintéticamente valioso, ya que la alquilación y desprotección de NS-amida N-monosustituida toma en condiciones más suaves. La aplicación de este protocolo se ha demostrado en la síntesis formal de (-) -metazocina.
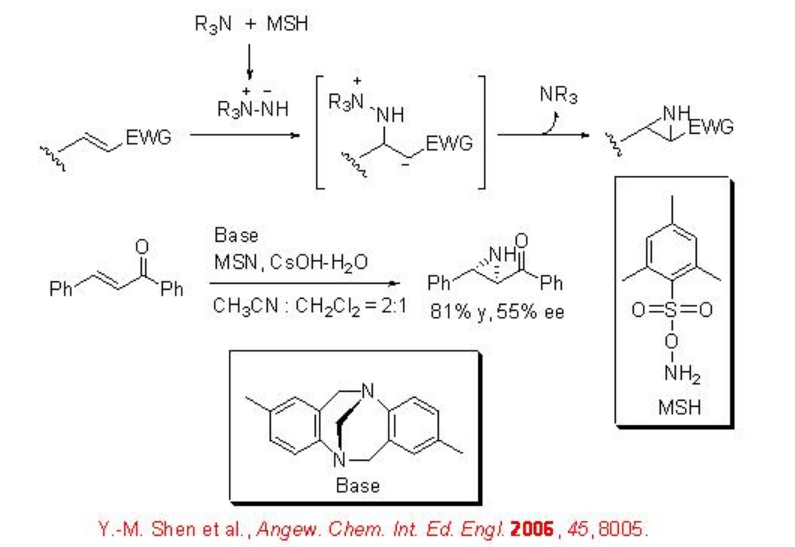
Se ha demostrado el uso de amina quiral para la reacción de alquenos deficientes en electrones. Por ejemplo, se reporta el uso de aminimida como reactivo efectivo de transferencia de NH para la aziridinación de alquenos deficientes en electrones (Esquema\(\PageIndex{4}\)). En esta reacción, se involucra la generación in situ de una sal de hidrazinio a partir de amina terciaria y O-mesitilensulfonilhidroxilamina (MSH), desprotonación de la sal de hidrazinio para formar una aminimida, y posterior aziridinación está involucrada.