1.4: Configuraciones de electrones y diagramas orbitales electrónicos (Revisión)
- Page ID
- 75871
Objetivo de aprendizaje
Dibujar, interpretar y convertir entre Lewis (Kekule), Condensada y Estructuras de Línea de Enlace
Nota: La revisión de química general en las secciones 1.3 - 1.6 se integra en el anterior Objetivo de Aprendizaje para la química orgánica en las secciones 1.7 y 1.8.
La configuración electrónica de un átomo es la representación de la disposición de los electrones distribuidos entre las conchas orbitales y subcáscaras. Comúnmente, la configuración electrónica se utiliza para describir los orbitales de un átomo en su estado fundamental, pero también puede ser utilizada para representar un átomo que se ha ionizado en un catión o anión compensando con la pérdida o ganancia de electrones en sus orbitales posteriores. Muchas de las propiedades físicas y químicas de los elementos pueden correlacionarse con sus configuraciones electrónicas únicas. Los electrones de valencia, electrones en la capa más externa, son el factor determinante para la química única del elemento.
Introducción
Antes de asignar los electrones de un átomo a orbitales, uno debe familiarizarse con los conceptos básicos de las configuraciones de electrones. Cada elemento de la Tabla Periódica consiste en átomos, los cuales están compuestos por protones, neutrones y electrones. Los electrones presentan una carga negativa y se encuentran alrededor del núcleo del átomo en orbitales electrónicos, definido como el volumen de espacio en el que el electrón se puede encontrar dentro del 95% de probabilidad. Los cuatro tipos diferentes de orbitales (s, p, d y f) tienen diferentes formas, y un orbital puede contener un máximo de dos electrones. Los orbitales p, d y f tienen diferentes subniveles, por lo que pueden contener más electrones.
Como se indicó, la configuración electrónica de cada elemento es única a su posición en la tabla periódica. El nivel de energía está determinado por el periodo y el número de electrones viene dado por el número atómico del elemento. Los orbitales en diferentes niveles de energía son similares entre sí, pero ocupan diferentes áreas en el espacio. El orbital 1s y el orbital 2s tienen las características de un s orbital (nodos radiales, probabilidades de volumen esférico, solo pueden contener dos electrones, etc.) pero, como se encuentran en diferentes niveles de energía, ocupan diferentes espacios alrededor del núcleo. Cada orbital puede ser representado por bloques específicos en la tabla periódica. El bloque s es la región de los metales alcalinos incluyendo helio (Grupos 1 y 2), el bloque d son los metales de transición (Grupos 3 a 12), el bloque p son los elementos principales del grupo de los Grupos 13 a 18, y el bloque f son las series de lantánidos y actínidos.
Usar la tabla periódica para determinar las configuraciones de electrones de los átomos es clave, pero también hay que tener en cuenta que existen ciertas reglas a seguir al asignar electrones a diferentes orbitales. La tabla periódica es una herramienta increíblemente útil para escribir configuraciones de electrones. Para obtener más información sobre cómo se vinculan las configuraciones de electrones y la tabla periódica, visite el módulo Conectando Electrones a la Tabla Periódica.
Reglas para la Asignación de Orbitales Electrónicos
Ocupación de Orbitales
Los electrones llenan los orbitales de manera que se minimiza la energía del átomo. Por lo tanto, los electrones en un átomo llenan los principales niveles de energía en orden de aumentar la energía (los electrones se están alejando del núcleo). El orden de los niveles llenos se ve así:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d y 7p
Una forma de recordar este patrón, probablemente el más fácil, es referirse a la tabla periódica y recordar dónde cae cada bloque orbital para deducir lógicamente este patrón. Otra forma es hacer una tabla como la de abajo y usar líneas verticales para determinar qué subshells se corresponden entre sí.

Principio de exclusión de Pauli
El principio de exclusión de Pauli establece que no hay dos electrones que puedan tener los mismos cuatro números cuánticos. Los tres primeros (n, l y m l) pueden ser iguales, pero el cuarto número cuántico debe ser diferente. Un solo orbital puede contener un máximo de dos electrones, los cuales deben tener espines opuestos; de lo contrario tendrían los mismos cuatro números cuánticos, lo cual está prohibido. Un electrón es spin up (m s = +1/2) y el otro giraría hacia abajo (m s = -1/2). Esto nos dice que cada subcapa tiene el doble de electrones por orbital. La subcapa s tiene 1 orbital que puede contener hasta 2 electrones, la subcapa p tiene 3 orbitales que pueden contener hasta 6 electrones, la subcapa d tiene 5 orbitales que sostienen hasta 10 electrones, y la subcapa f tiene 7 orbitales con 14 electrones.
Ejemplo 1: Hidrógeno y helio
Los tres primeros números cuánticos de un electrón son n=1, l=0, m l =0. Sólo dos electrones pueden corresponder a estos, que serían o bien m s = -1/2 o m s = +1/2. Como ya sabemos de nuestros estudios de números cuánticos y orbitales de electrones, podemos concluir que estos cuatro números cuánticos se refieren a la subcapa 1s. Si solo se da uno de los valores de m s entonces tendríamos 1s 1 (denotando hidrógeno) si ambos se dan tendríamos 1s 2 (denotando helio). Visualmente, esto se representa como:
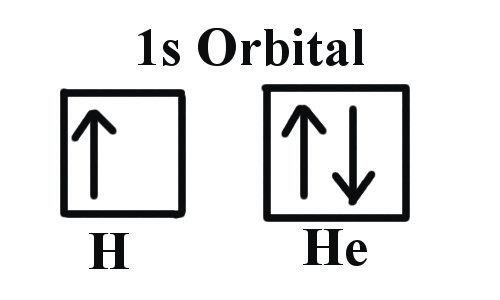
Como se muestra, la subcapa 1s puede contener solo dos electrones y, cuando se llena, los electrones tienen espines opuestos.
Regla del perro
Al asignar electrones en orbitales, cada electrón primero llenará todos los orbitales con energía similar (también denominada degenerada) antes de emparejarse con otro electrón en un orbital medio lleno. Los átomos en los estados terrestres tienden a tener tantos electrones desapareados como sea posible. Al visualizar estos procesos, piense en cómo los electrones están exhibiendo el mismo comportamiento que lo harían los mismos polos en un imán si entraran en contacto; a medida que los electrones cargados negativamente llenan orbitales primero intentan llegar lo más lejos posible entre sí antes de tener que emparejarse.
Ejemplo 2: Oxígeno y Nitrógeno
Si observamos la correcta configuración electrónica del átomo de Nitrógeno (Z = 7), un elemento muy importante en la biología de las plantas: 1s 2 2s 2 2p 3
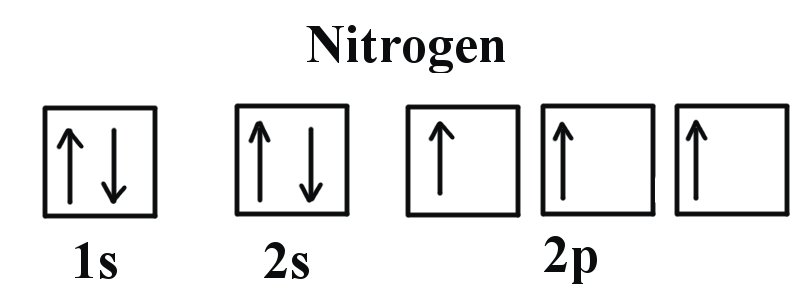
Podemos ver claramente que los orbitales p están medio llenos ya que hay tres electrones y tres orbitales p. Esto se debe a que la Regla de Hund establece que los tres electrones en la subcapa 2p llenarán primero todos los orbitales vacíos antes de llenar los orbitales con electrones en ellos. Si observamos el elemento después del Nitrógeno en el mismo periodo, Oxígeno (Z = 8) su configuración electrónica es: 1s 2 2s 2 2p 4 (para un átomo).
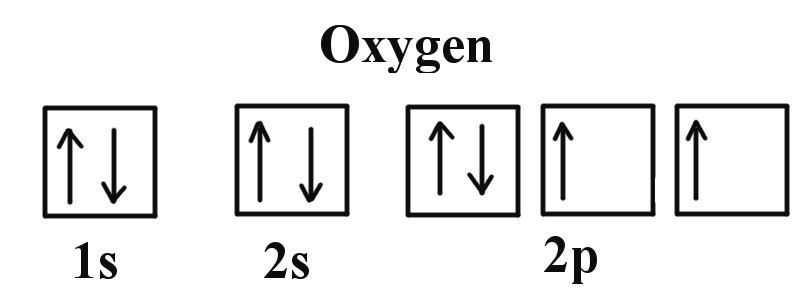
El oxígeno tiene un electrón más que el Nitrógeno y como los orbitales están todos medio llenos, el electrón debe emparejarse.
El Proceso Aufbau
Aufbau proviene de la palabra alemana “aufbauen” que significa “construir”. Al escribir configuraciones electrónicas, los orbitales se construyen de átomo a átomo. Al escribir la configuración electrónica para un átomo, los orbitales se rellenan en orden de aumento del número atómico. No obstante, hay algunas excepciones a esta regla.
Ejemplo 3:3 elementos de la fila rd
Siguiendo el patrón a lo largo de un período de B (Z=5) a Ne (Z=10), el número de electrones aumenta y las subcapas se llenan. Este ejemplo se centra en la subcapa p, que llena de boro a neón.
- B (Z=5) configuración: 1s 2 2s 2 2p 1
- C (Z=6) configuración:1s 2 2s 2 2p 2
- N (Z=7) configuración:1s 2 2s 2 2p 3
- O (Z=8) configuración:1s 2 2s 2 2p 4
- F (Z=9) configuración:1s 2 2s 2 2p 5
- Ne (Z=10) configuración:1s 2 2s 2 2p 6
E xample
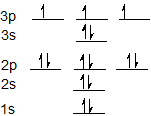
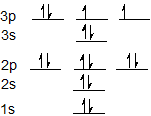
La configuración electrónica para azufre es 1s 2 2s 2 2p 6 3 s 2 3p 4 y se puede representar usando el diagrama orbital a continuación.
Ejercicios
Escribe la configuración electrónica para el fósforo y dibuja el diagrama orbital.
Solución:
La configuración electrónica para fósforo es 1s 2 2s 2 2p 6 3 s 2 3p 3 y el diagrama orbital se dibuja a continuación.