1.7: Patrones de unión comunes para química orgánica
- Page ID
- 75885
Objetivo de aprendizaje
Dibujar, interpretar y convertir entre Lewis (Kekule), Condensada y Estructuras de Línea de Enlace
Nota: La revisión de química general en las secciones 1.3 - 1.6 se integra en el anterior Objetivo de Aprendizaje para la química orgánica en las secciones 1.7 y 1.8.
Patrones de unión comunes en estructuras orgánicas
La estructura de Lewis a continuación (de uno de los cuatro bloques de construcción de nucleósidos que componen el ADN) puede parecer compleja y confusa a primera vista. Afortunadamente, se producen patrones de unión comunes que pueden permitir simplificaciones al dibujar estructuras. Las reglas para las estructuras simplificadas se basan principalmente en los patrones de unión neutros para carbono, orígeno, nitrógeno, fósforo y azufre. Dado que los compuestos orgánicos tienen una cadena principal hidrocarbonada, los átomos que NO son carbono e hidrógeno se denominan heteroátomos. La 2'-desoxicitidina contiene siete heteroátomos: cuatro átomos de oxígeno aterrizan tres átomos de nitrógeno. Los heteroátomos son una fuente primaria de reactividad química para la química orgánica.
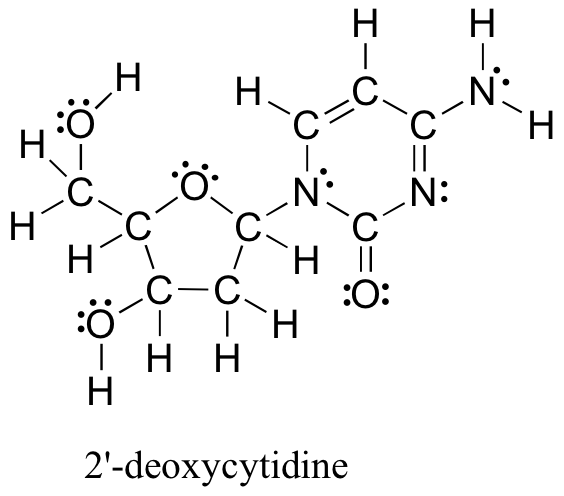
Heteroátomos: átomos en un compuesto orgánico que NO son carbono o hidrógeno,
típicamente oxígeno, nitrógeno, fósforo y azufre
L a capacidad para dibujar estructuras grandes de manera rápida y eficiente y determinar cargos formales no es terriblemente difícil de conseguir; todo lo que se necesita son algunos atajos y algo de práctica para reconocer patrones de vinculación comunes.
Empecemos por el carbono, el elemento más importante para los químicos orgánicos. Se dice que el carbono es tetravalente, lo que significa que tiende a formar cuatro enlaces. Si observas las estructuras simples del metano, metanol, etano, eteno y etino en las cifras de la sección anterior, deberías reconocer rápidamente que en cada molécula, el átomo de carbono tiene cuatro enlaces, y una carga formal de cero.
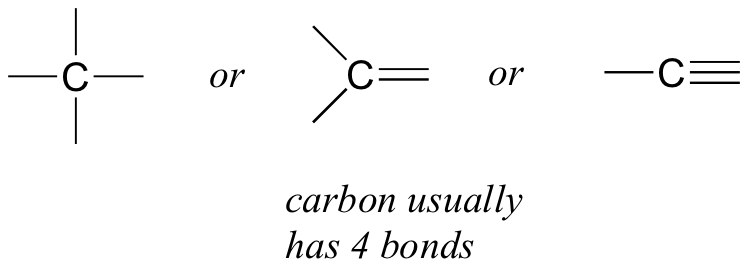
Este es un patrón que sostiene a lo largo de la mayoría de las moléculas orgánicas que veremos, pero también hay excepciones.
<style type="text/css"></style>En el dióxido de carbono, el átomo de carbono tiene dobles enlaces al oxígeno en ambos lados (O=C=O). Más adelante en este capítulo y a lo largo de este libro veremos ejemplos de iones orgánicos llamados 'carbocationes' y carbaniones ', en los que un átomo de carbono lleva una carga formal positiva o negativa, respectivamente. Si un carbono tiene sólo tres bonos y una concha de valencia sin llenar (es decir, si no cumple con la regla del octeto), tendrá una carga formal positiva.
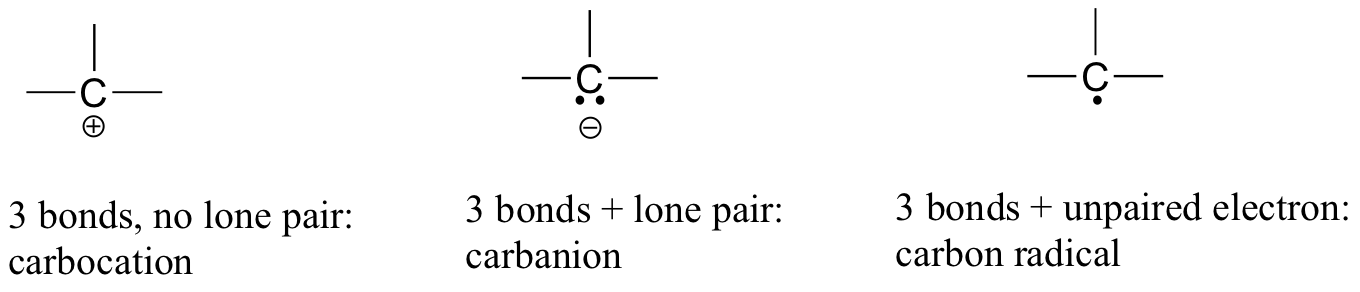
Si, por otro lado, tiene tres enlaces más un par solitario de electrones, tendrá una carga formal de -1. Otra posibilidad es un carbono con tres enlaces y un solo electrón desapareado (radical libre): en este caso, el carbono tiene una carga formal de cero. (Una última posibilidad es una especie altamente reactiva llamada 'carbeno', en la que un carbono tiene dos enlaces y un par solitario de electrones, dándole una carga formal de cero. Es posible que encuentres carbenos en cursos de química más avanzados, pero no se discutirán más en este libro).
Sin duda debe utilizar los métodos que ha aprendido para verificar que estos cargos formales sean correctos para los ejemplos dados anteriormente. Más importante aún, necesitará, antes de avanzar mucho más en su estudio de la química orgánica, simplemente reconocer estos patrones (y los patrones descritos a continuación para otros átomos) y poder identificar los carbonos que llevan cargas formales positivas y negativas mediante una inspección rápida.
El patrón para los hidrógenos es fácil: los átomos de hidrógeno tienen un solo enlace, y ninguna carga formal. Las excepciones a esta regla son el protón, H +, y el ion hidruro, H -, que es un protón más dos electrones. Debido a que nos estamos concentrando en este libro sobre la química orgánica aplicada a los seres vivos, sin embargo, no vamos a estar viendo protones e hidruros 'desnudos' como tales, porque son demasiado reactivos para estar presentes en esa forma en solución acuosa. Sin embargo, la idea de un protón será muy importante cuando discutamos la química ácido-base, y la idea de un ion hidruro será muy importante mucho más adelante en el libro cuando discutamos las reacciones de oxidación y reducción orgánicas. Sin embargo, como regla general, todos los átomos de hidrógeno en las moléculas orgánicas tienen un enlace, y ninguna carga formal.
Pasemos a continuación a los átomos de oxígeno. Por lo general, verá un enlace de oxígeno de tres maneras, todas las cuales cumplen con la regla del octeto.
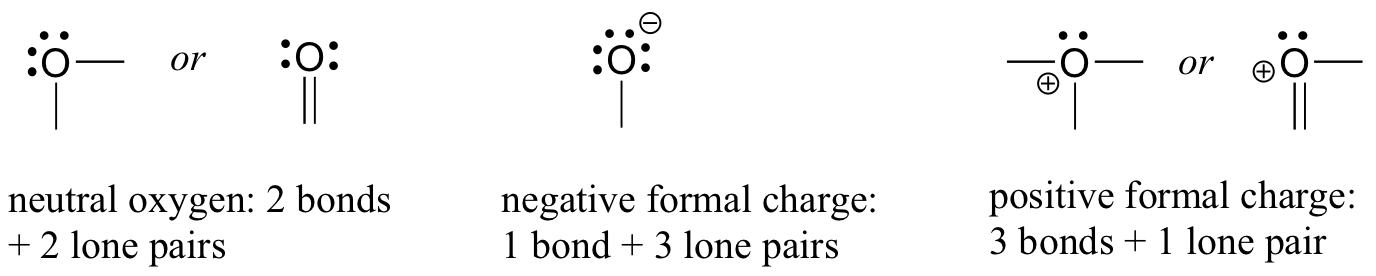
Si tiene dos bonos y dos pares solitarios, como en el agua, tendrá una carga formal de cero. Si tiene un enlace y tres pares solitarios, como en el ion hidróxido, tendrá una carga formal de-1. Si tiene tres enlaces y un par solitario, como en el ion hidronio, tendrá una carga formal de +1.
Cuando lleguemos a nuestra discusión sobre la química de los radicales libres en el capítulo 17, veremos otras posibilidades, como donde un átomo de oxígeno tiene un enlace, un par solitario y un electrón desapareado (radical libre), dándole una carga formal de cero. Por ahora, sin embargo, concéntrese en los tres principales ejemplos no radicales, ya que estos darán cuenta de prácticamente todo lo que vemos hasta el capítulo 17.
El nitrógeno tiene dos patrones de unión principales, los cuales cumplen con la regla del octeto:
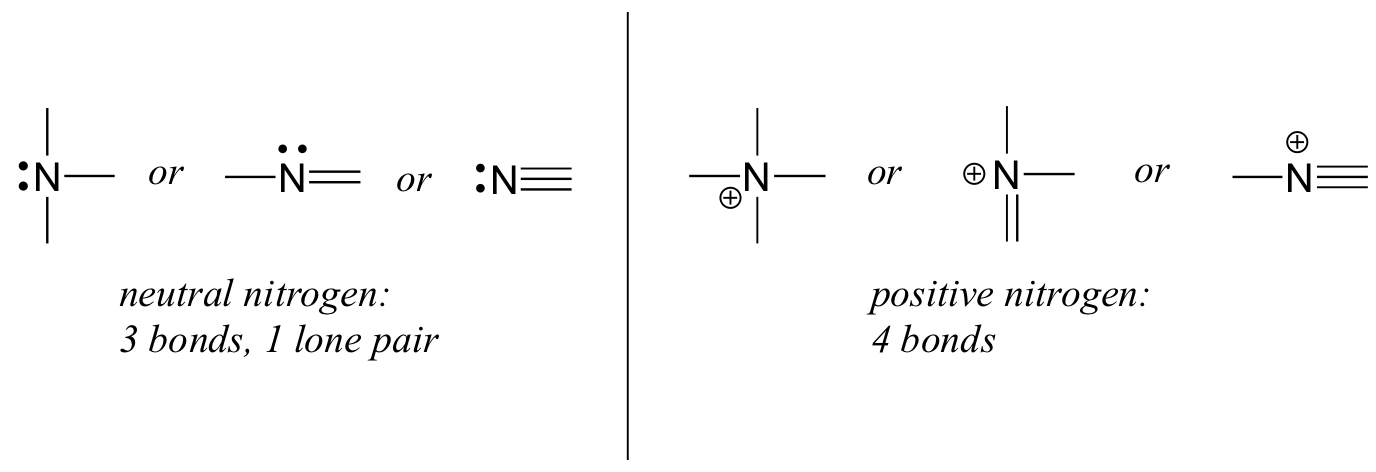
Si un nitrógeno tiene tres enlaces y un par solitario, tiene una carga formal de cero. Si tiene cuatro bonos (y ningún par solitario), tiene un cargo formal de +1. En un patrón de unión bastante poco común, el nitrógeno cargado negativamente tiene dos enlaces y dos pares solitarios.
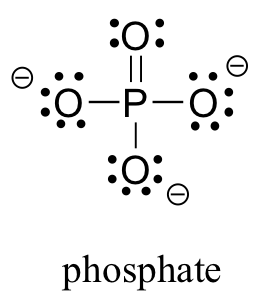
Dos elementos de la tercera fila se encuentran comúnmente en moléculas orgánicas biológicas: azufre y fósforo. Aunque ambos elementos tienen otros patrones de unión que son relevantes en la química de laboratorio, en un contexto biológico el azufre casi siempre sigue el mismo patrón de unión/carga formal que el oxígeno, mientras que el fósforo está presente en forma de ion fosfato (PO 4 3-), donde tiene cinco enlaces (casi siempre al oxígeno), sin pares solitarios, y una carga formal de cero. Recuerde que los átomos de los elementos en la tercera fila y abajo en la tabla periódica tienen 'conchas de valencia expandidas' con d orbitales disponibles para la unión, y la regla del octeto no aplica.
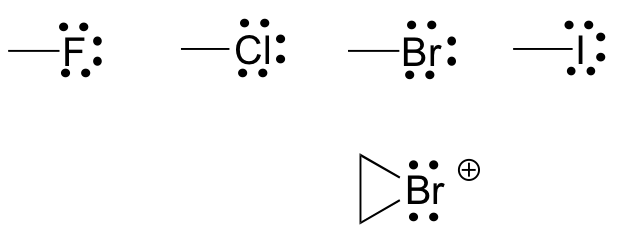
Finalmente, los halógenos (flúor, cloro, bromo y yodo) son muy importantes en la química orgánica de laboratorio y medicinal, pero menos comunes en las moléculas orgánicas naturales. Los halógenos en los compuestos orgánicos generalmente se ven con un enlace, tres pares solitarios y una carga formal de cero. En ocasiones, especialmente en el caso del bromo, nos encontraremos con especies reactivas en las que el halógeno tiene dos enlaces (generalmente en un anillo de tres elementos), dos pares solitarios, y una carga formal de +1.
Estas reglas, si se aprenden e internalizan para que ni siquiera necesites pensar en ellas, te permitirán dibujar grandes estructuras orgánicas, completas con cargos formales, con bastante rapidez.
Una vez que hayas captado la idea de dibujar estructuras de Lewis, no siempre es necesario dibujar pares solitarios sobre heteroátomos, ya que puedes suponer que el número adecuado de electrones está presente alrededor de cada átomo para que coincida con la carga formal indicada (o la falta de ella). Ocasionalmente, sin embargo, se dibujan pares solitarios si hacerlo ayuda a que una explicación sea más clara.

