1.6: Estructuras de Lewis y Cargos Formales (Revisión)
- Page ID
- 75880
Objetivo de aprendizaje
Dibujar, interpretar y convertir entre estructuras de Lewis (Kekule), Condensed y Bond-line
Nota: La revisión de química general en las secciones 1.3 - 1.6 se integra en el anterior Objetivo de Aprendizaje para la química orgánica en las secciones 1.7 y 1.8.
Estructuras de Lewis
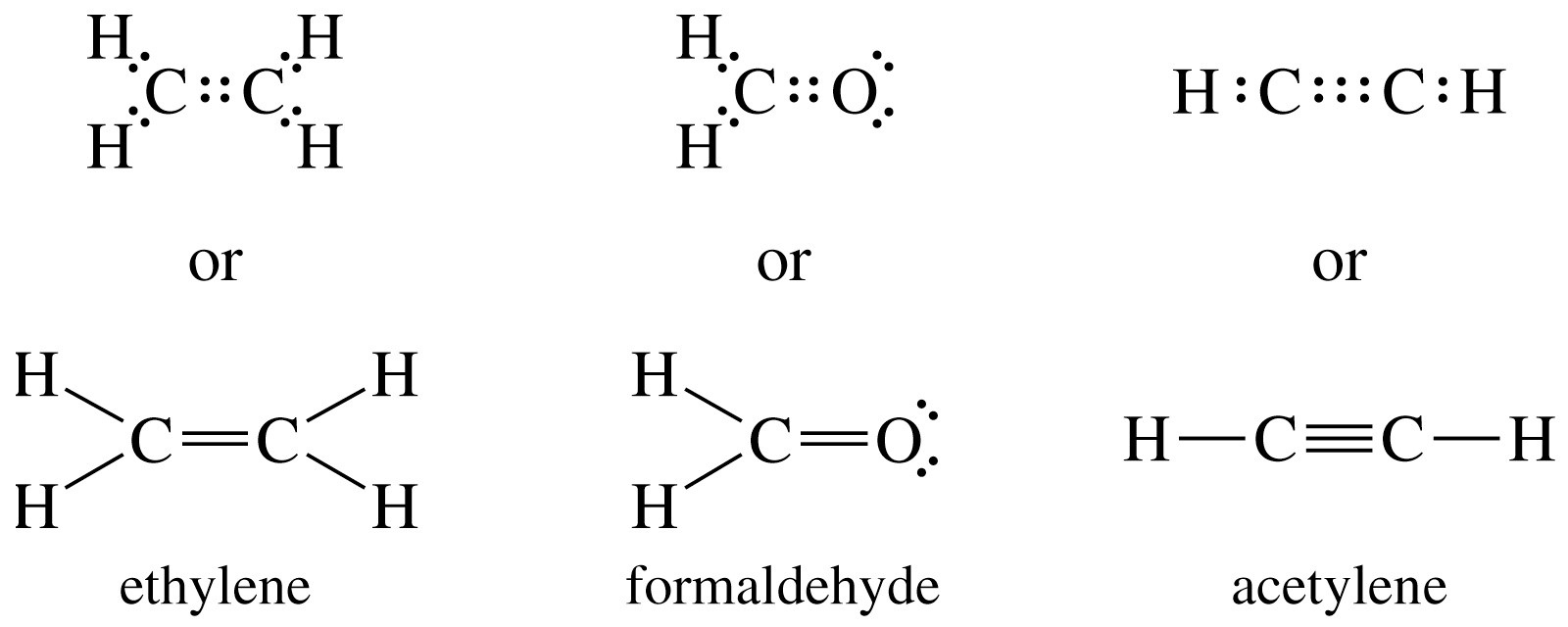
Las estructuras de Lewis, también conocidas como diagramas de puntos de Lewis, muestran la relación de unión entre los átomos de una molécula y los pares solitarios de electrones en una molécula. Si bien inicialmente puede ser útil escribir los electrones compartidos individuales, este enfoque rápidamente se vuelve incómodo.
Una sola línea se utiliza para representar un par de electrones compartidos. Las representaciones de líneas solo se utilizan para electrones compartidos. Los electrones de pares solitarios (no compartidos) todavía se muestran como electrones individuales. Los enlaces dobles y triples también se pueden comunicar con líneas como se muestra a continuación.
2 electrones compartidos forman un enlace sencillo que se muestra como ':' o '—'
4 electrones compartidos forman un doble enlace que se muestra como ': :' o' = '
6 electrones compartidos se forman en el triple enlace mostrado como ': ::' o
Los electrones no compartidos también se llaman 'Pares Solitarios' y se muestran como ':'
Dibujo de Pares Solitarios
Dado que los electrones del par solitario a menudo NO se muestran en las estructuras químicas, es importante agregar mentalmente los pares solitarios. Al principio, puede ser útil agregar físicamente los electrones del par solitario.
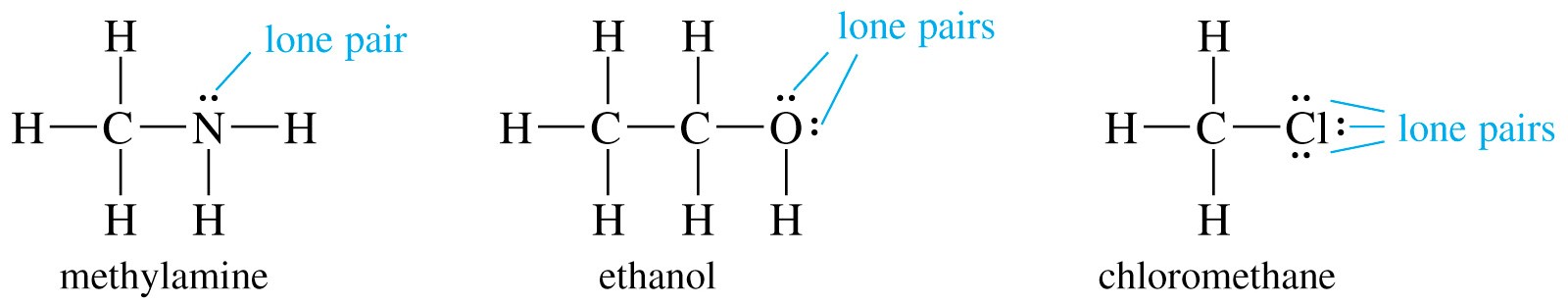
Patrones de unión
Para la química orgánica, los patrones de unión comunes de carbono, oxígeno y nitrógeno tienen aplicaciones útiles a la hora de evaluar estructuras químicas y reactividad.
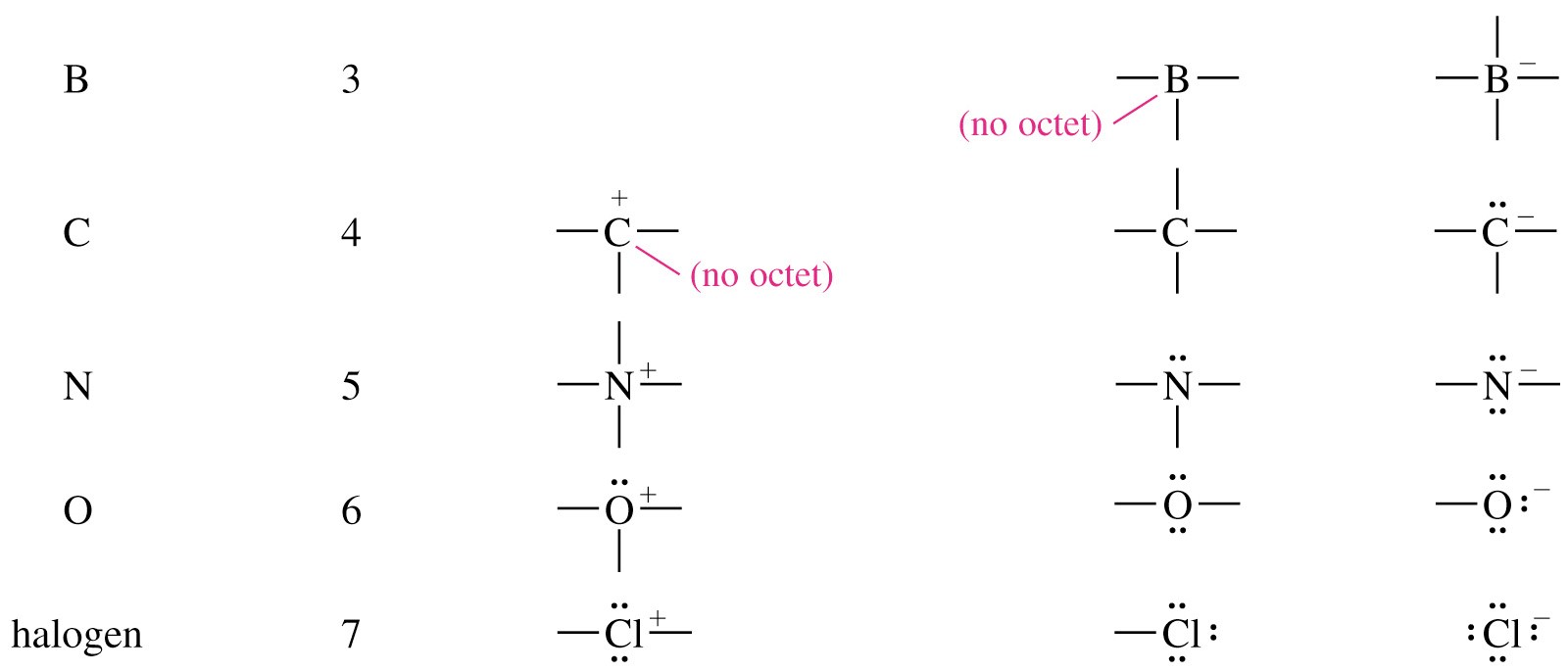
Cargos formales
Las moléculas orgánicas también pueden tener cargas positivas o negativas asociadas con ellas. Durante las reacciones químicas, es común tener reactivo de carga, intermedios y/o productos. Reconocer y distinguir entre patrones de vinculación neutros y cargados será útil en el aprendizaje de los mecanismos de reacción. Consideremos la estructura Lewis del metanol, CH 3 OH (el metanol es el llamado 'alcohol de madera' que los trafistas sin escrúpulos vendían a veces durante los días de prohibición en la década de 1920, haciendo que muchas veces las personas que lo bebían quedaran ciegas). El metanol en sí es una molécula neutra, pero puede perder un protón para convertirse en un anión molecular (CH 3 O -), o ganar un protón para convertirse en un catión molecular (CH 3 OH 2 +).

El anión molecular y el catión tienen cargas globales de -1 y +1, respectivamente. Pero podemos ser más específicos que eso -también podemos afirmar para cada ion molecular que una carga formal se localiza específicamente en el átomo de oxígeno, más que en el carbono o cualquiera de los átomos de hidrógeno.
Descubrir la carga formal en diferentes átomos de una molécula es un proceso sencillo, es simplemente una cuestión de sumar electrones de valencia.
Un átomo de oxígeno no unido tiene 6 electrones de valencia. Sin embargo, cuando se une como parte de una molécula de metanol, un átomo de oxígeno está rodeado por 8 electrones de valencia: 4 electrones no enlazantes (dos 'pares solitarios') y 2 electrones en cada uno de sus dos enlaces covalentes (uno al carbono, uno al hidrógeno). En la convención formal de carga, decimos que el oxígeno 'posee' los 4 electrones no enlazantes. Sin embargo, solo 'posee' un electrón de cada uno de los dos enlaces covalentes, porque los enlaces covalentes implican la compartición de electrones entre átomos. Por lo tanto, el átomo de oxígeno en metanol posee 2 + 2 + (½ x 4) = 6 electrones de valencia.
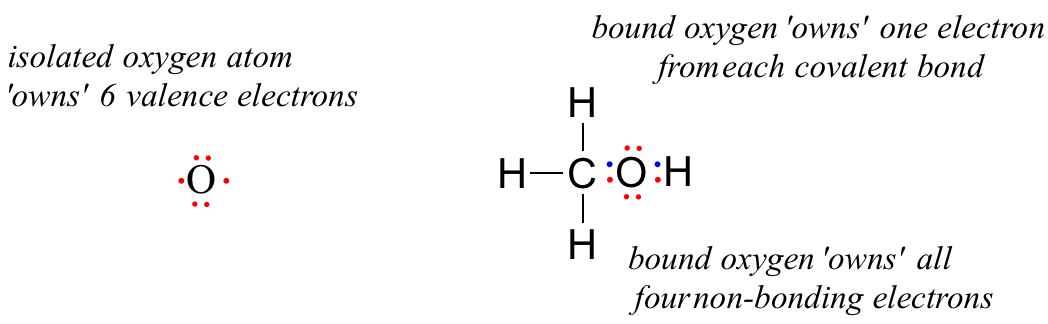
La carga formal sobre un átomo se calcula como el número de electrones de valencia propiedad del átomo aislado menos el número de electrones de valencia propiedad del átomo unido en la molécula:

