1.9: Electronegatividad y Polaridad de Enlace (Revisión)
- Page ID
- 75934
Objetivo de aprendizaje
- Identificar enlaces polares y compuestos
La electronegatividad es una medida de la tendencia de un átomo a atraer un par de electrones de unión. La escala Pauling es la más utilizada. Al flúor (el elemento más electronegativo) se le asigna un valor de 4.0, y los valores varían hasta el cesio y el francio que son los menos electronegativos a 0.7.
Patrones de electronegatividad en la Tabla Periódica
La electronegatividad se define como la capacidad de un átomo en una molécula particular para atraer electrones hacia sí mismo. Cuanto mayor sea el valor, mayor será el atractivo para los electrones.
Tendencias de la electronegatividad a lo largo de un periodo
Los protones cargados positivamente en el núcleo atraen a los electrones cargados negativamente. A medida que aumente el número de protones en el núcleo, se incrementará la electronegatividad o atracción. Por lo tanto, la electronegatividad aumenta de izquierda a derecha en fila en la tabla periódica. Este efecto sólo es válido para una fila en la tabla periódica porque la atracción entre cargas cae rápidamente con la distancia. El gráfico muestra electronegatividades desde el sodio hasta el cloro (ignorando el argón ya que no forma enlaces).
Tendencias en electronegatividad bajando un grupo
A medida que vas bajando de grupo, la electronegatividad disminuye. (Si aumenta hasta el flúor, debe disminuir a medida que bajes.) El gráfico muestra los patrones de electronegatividad en los Grupos 1 y 7.
Explicando los patrones en la electronegatividad
La atracción que un par de electrones de unión siente por un núcleo particular depende de:
- el número de protones en el núcleo;
- la distancia desde el núcleo;
- la cantidad de cribado por electrones internos.
¿Por qué aumenta la electronegatividad a lo largo de un periodo?
Considera el sodio al inicio del periodo 3 y el cloro al final (ignorando el gas noble, el argón). Piense en el cloruro de sodio como si estuviera unido covalentemente.
Tanto el sodio como el cloro tienen sus electrones de unión en el nivel 3. El par de electrones es tamizado de ambos núcleos por los electrones 1s, 2s y 2p, pero el núcleo de cloro tiene 6 protones más en él. No es de extrañar que el par de electrones sea arrastrado tan lejos hacia el cloro que se forman los iones. La electronegatividad aumenta a lo largo de un periodo debido a que aumenta el número de cargas en el núcleo. Eso atrae más fuertemente al par de electrones de unión.
¿Por qué cae la electronegatividad a medida que bajas un grupo?
A medida que se baja de un grupo, la electronegatividad disminuye porque el par de electrones de unión se aleja cada vez más de la atracción del núcleo. Considere las moléculas de fluoruro de hidrógeno y cloruro de hidrógeno:
El par de unión está blindado del núcleo del flúor solo por los electrones 1s 2. En el caso del cloro está blindado por todos los 1s 2 2s 2 2p 6 electrones. En cada caso hay un tirón neto desde el centro del flúor o cloro de +7. Pero el flúor tiene el par de unión en el nivel 2 en lugar del nivel 3 ya que está en el cloro. Si está más cerca del núcleo, la atracción es mayor.
Los momentos dipolares ocurren cuando hay una separación de carga. Pueden ocurrir entre dos iones en un enlace iónico o entre átomos en un enlace covalente; los momentos dipolares surgen de diferencias en la electronegatividad. Cuanto mayor sea la diferencia en la electronegatividad, mayor será el momento dipolar. La distancia entre la separación de carga también es un factor decisivo en el tamaño del momento dipolar. El momento dipolar es una medida de la polaridad de la molécula.
Polaridad de enlace y momento dipolo
Los átomos con diferencias en la electronegatividad compartirán electrones de manera desigual. Los electrones compartidos del enlace covalente se mantienen más apretados en el elemento más electronegativo creando una carga negativa parcial, mientras que el elemento menos electronegativo tiene una carga positiva parcial,. Cuanto mayor sea la diferencia de electronegatividad entre los dos átomos, más polar será el enlace. Para ser considerado un vínculo polar, la diferencia en la electronegatividad debe >0.4 en la escala de Pauling. Dado que las dos cargas parciales eléctricas tienen signo opuesto e igual magnitud y están separadas por una distancia, se establece un dipolo. El momento dipolo se mide en unidades debye, que es igual a la distancia entre las cargas multiplicada por la carga (1 debye equivale a 3.34 x 10-30 culombios-metros).
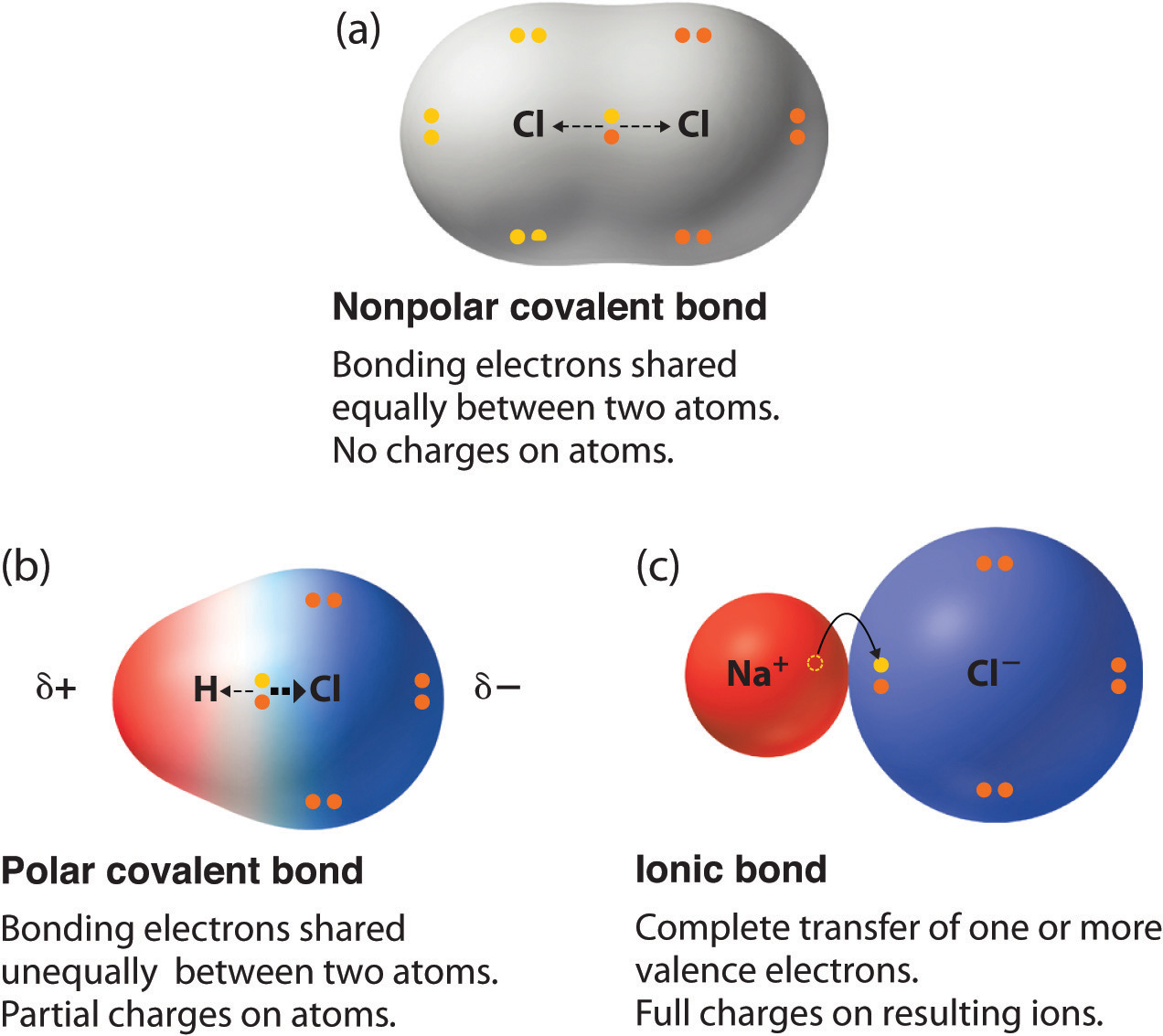
Polaridad y Estructura de Moléculas
La forma de una molécula Y la polaridad de sus enlaces. Una molécula que contiene enlaces polares, podría no tener ninguna polaridad global, dependiendo de su forma. La definición simple de si una molécula compleja es polar o no depende de si sus centros globales de cargas positivas y negativas se superponen. Si estos centros se encuentran en el mismo punto en el espacio, entonces la molécula no tiene polaridad global (y es no polar).
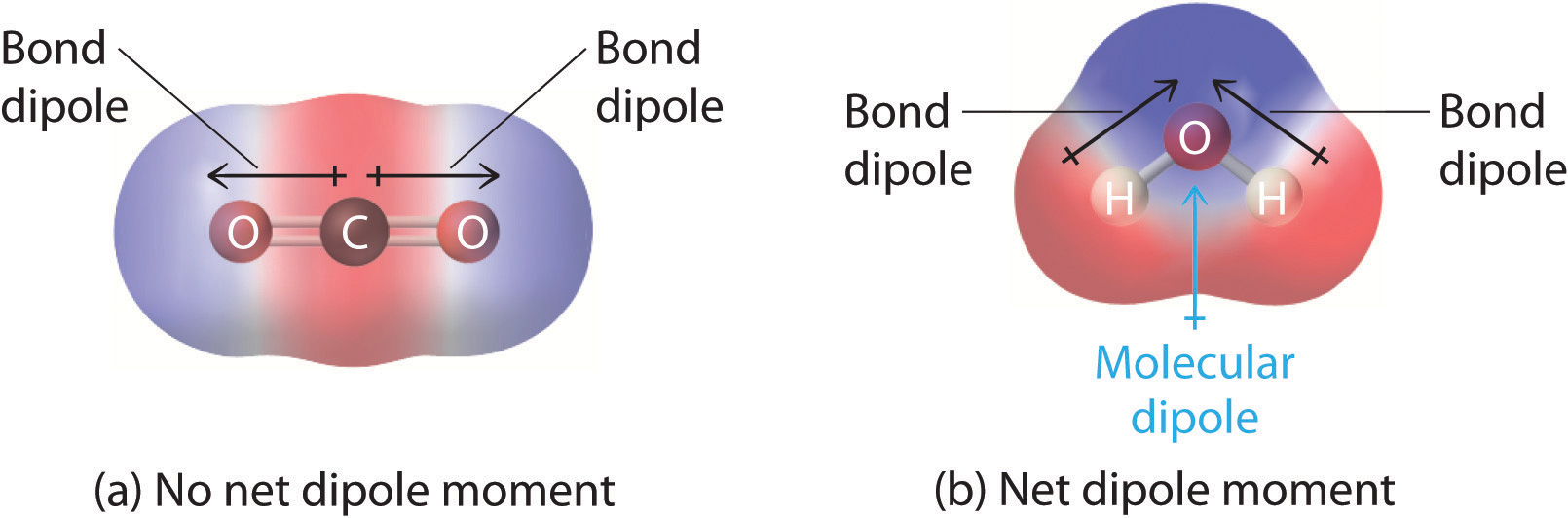
Si una molécula es completamente simétrica, entonces los vectores de momento dipolo en cada molécula se cancelarán entre sí, haciendo que la molécula sea no polar. Una molécula sólo puede ser polar si la estructura de esa molécula no es simétrica.
Un buen ejemplo de una molécula no polar que contiene enlaces polares es el dióxido de carbono. Esta es una molécula lineal y los enlaces C=O son, de hecho, polares. El carbono central tendrá una carga positiva neta, y los dos oxígenos externos una carga neta negativa. Sin embargo, dado que la molécula es lineal, estos dos dipolos de enlace se cancelan entre sí (es decir, la adición vectorial de los dipolos es igual a cero). Y la molécula general no tiene dipolo (μ = 0.
Aunque un enlace polar es un requisito previo para que una molécula tenga un dipolo, no todas las moléculas con enlaces polares presentan dipolos

