1.10: Resonancia
- Page ID
- 75896
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Objetivo de aprendizaje
- Dibujar formas de resonancia y predecir la contribución relativa de cada forma de resonancia a la estructura general del compuesto o ion
Reconocer resonancia
Los contribuyentes de resonancia implican el 'movimiento imaginario' de electrones unidos a pi o de electrones de pares solidos que están adyacentes a (es decir, conjugados a) enlaces pi. Nunca se puede desplazar la ubicación de los electrones en los enlaces sigma; si muestra que un enlace sigma se forma o se rompe, está mostrando una reacción química que tiene lugar. Asimismo, las posiciones de los átomos en la molécula no pueden cambiar entre dos contribuyentes de resonancia.
Debido a que el benceno aparecerá a lo largo de este curso, es importante reconocer la estabilidad obtenida a través de la deslocalización de resonancia de los seis electrones pi a lo largo de los seis átomos de carbono. El benceno también ilustra una forma de reconocer la resonancia, cuando es posible dibujar dos o más strucutres de Lewis equivalentes. Si tuviéramos que dibujar la estructura de una molécula aromática como el 1,2-dimetilbenceno, hay dos formas en las que podríamos dibujar los dobles enlaces:
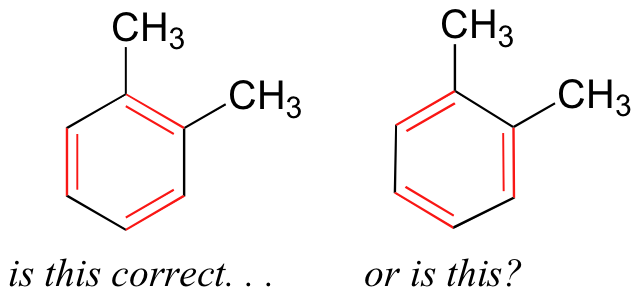
¿Cuál es el camino correcto? Hay dos respuestas simples a esta pregunta: 'ambas' y 'ninguna de las'. Ambas formas de dibujar la molécula son aproximaciones igualmente aceptables de la imagen de unión para la molécula, pero ninguna, por sí misma, es una imagen precisa de los enlaces pi deslocalizados. Los dos dibujos alternativos, sin embargo, cuando se consideran juntos, dan una imagen mucho más precisa que cualquiera de los dos por sí solo. Esto se debe a que implican, en conjunto, que los enlaces carbono-carbono no son dobles enlaces, no enlaces simples, sino aproximadamente a mitad de camino entre ellos.
Cuando es posible dibujar más de una estructura válida para un compuesto o ion, hemos identificado contribuyentes de resonancia: dos o más estructuras de Lewis diferentes que representan la misma molécula o ion que, cuando se consideran juntas, hacen un mejor trabajo de aproximación de enlaces pi deslocalizados que cualquier otro estructura única. Por convención, los contribuyentes de resonancia están vinculados por una flecha de dos puntas, y a veces están encerrados entre paréntesis:

Para facilitar la visualización de la diferencia entre dos contribuyentes de resonancia, a menudo se utilizan flechas pequeñas y curvas. Cada una de estas flechas representa el 'movimiento' de dos electrones pi. A partir de ahora en algunos capítulos, cuando comencemos a estudiar las reacciones orgánicas -un proceso en el que los desplazamientos de densidad de electrones y los enlaces covalentes entre los átomos se rompen y forman- esta 'notación de flecha curva' se volverá extremadamente importante para representar el movimiento de los electrones. En el dibujo de los contribuyentes de resonancia, sin embargo, este 'movimiento' de electrones ocurre solo en nuestras mentes, ya que tratamos de visualizar enlaces pi deslocalizados. Sin embargo, el uso de la notación de flecha curva es una habilidad esencial que necesitará desarrollar en el dibujo de contribuyentes de resonancia.
La representación del benceno usando los dos contribuyentes de resonancia A y B en la figura anterior no implica que la molécula en un momento se vea como la estructura A, luego en el momento siguiente se desplaza para parecerse a la estructura B. Más bien, en todos los momentos, la molécula es una combinación, o resonancia híbrido tanto de A como de B.
¡Precaución! Es muy importante tener claro que al dibujar dos (o más) contribuyentes de resonancia, no estamos dibujando dos moléculas diferentes: son simplemente representaciones diferentes de la misma molécula exacta. Además, la flecha de resonancia de doble punta NO significa que se haya producido una reacción química.
Por lo general, los derivados del benceno (y los grupos fenilo, cuando el anillo de benceno se incorpora a una estructura orgánica más grande) se representan con un solo contribuyente de resonancia, y se supone que el lector entiende que la hibridación por resonancia está implícita. Esta es la convención que se utilizará en su mayor parte en este libro. En otros libros o artículos, a veces puede verse benceno o un grupo fenilo dibujado con un círculo dentro del hexágono, ya sea sólido o discontinuo, como una forma de dibujar un híbrido de resonancia.
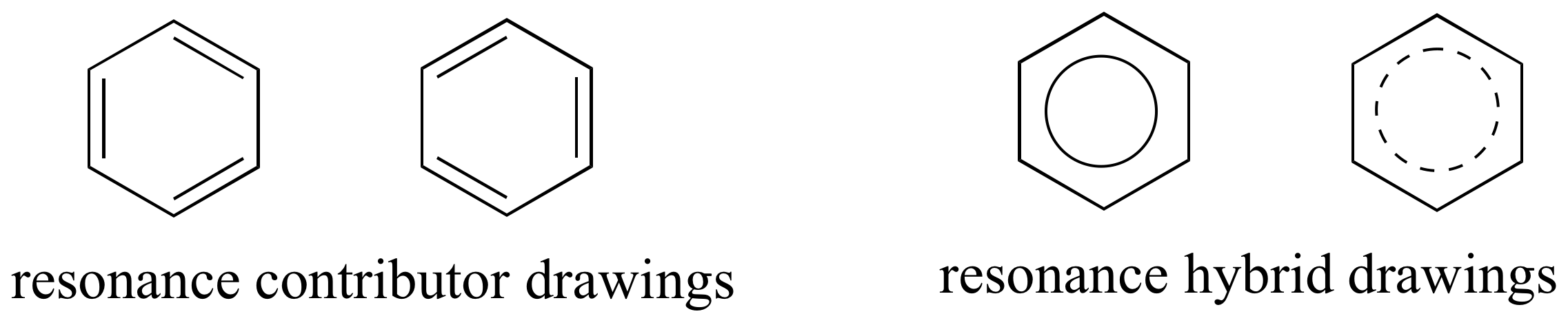
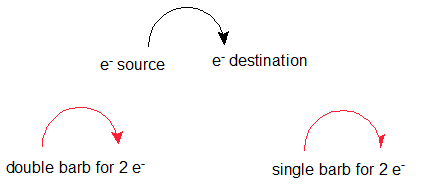
Flechas curvas comunican el flujo de electrones (movimiento)
Las flechas curvas indican flujo de electrones. La base de la flecha curva se coloca en la fuente de los electrones que se mueven. La cabeza de la flecha se coloca en el destino de los electrones. Una sola flecha barbada representa un electrón y una doble púa representa dos electrones. Los electrones se mueven de regiones de densidad relativamente alta a regiones de baja densidad o hacia elementos electronegativos. Es importante utilizar la precisión y precisión al dibujar flechas curvas.
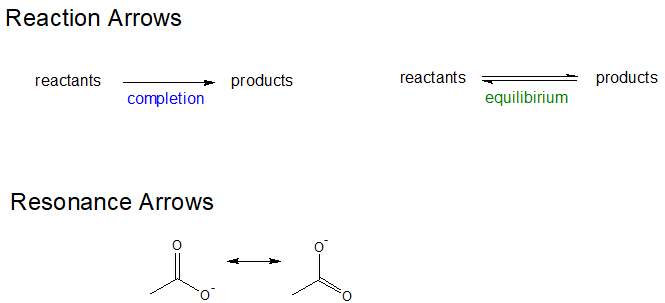
También es importante utilizar conscientemente el tipo correcto de flecha. Existen cuatro tipos primarios de flechas utilizadas por los químicos para comunicar uno de los siguientes: reacción de finalización, reacción de equilibrio, movimiento de electrones, formas de resonancia. Los otros tres tipos de flechas se muestran a continuación para construir el discernimiento entre ellas.
La resonancia deslocaliza la carga para aumentar la estabilidad
La resonancia es más útil cuando deslocaliza la carga para estabilizar intermedios reactivos y productos. Reconocer, dibujar y evaluar la estabilidad relativa de los contribuyentes de resonancia es esencial para comprender los mecanismos de reacción orgánica.
Lineamientos para dibujar y trabajar con contribuyentes de resonancia
Aprendiendo a dibujar e interpretar estructuras de resonancia, existen algunas pautas básicas para ayudar a evitar dibujar estructuras sin sentido. Todas estas guías tienen perfecto sentido siempre y cuando recordemos que los contribuyentes de resonancia son simplemente una convención inventada por humanos para representar la deslocalización de electrones pi en sistemas conjugados. Cuando vemos dos contribuyentes de resonancia diferentes, ¡no estamos viendo una reacción química! Estamos viendo exactamente la misma molécula o ion representado de dos maneras diferentes. Todos los contribuyentes de resonancia deben ser dibujados como estructuras de Lewis adecuadas, con cargos formales correctos. Nunca mostrar flechas curvadas de 'movimiento electrónico' que conduzcan a una situación en la que un elemento de la segunda fila (es decir, carbono, nitrógeno u oxígeno) tenga más de ocho electrones: esto rompería la 'regla del octeto'. A veces, sin embargo, dibujaremos contribuyentes de resonancia en los que un átomo de carbono tiene sólo seis electrones (es decir, un carbocatión). En general, todos los átomos de oxígeno y nitrógeno deben tener un octeto completo de electrones de valencia.
1. Hay SOLO UNA ESTRUCTURA por cada compuesto o ion. Esta estructura toma su carácter de la suma de todos los contribuyentes, no todas las estructuras de resonancia contribuyen por igual a la suma.
2. Los átomos deben mantener su misma posición.
3. ¡Sólo e- muévete!
4. Todos los contribuyentes de resonancia para una molécula o ion deben tener la misma carga neta.
5. Reconocer qué electrones pueden participar en la resonancia
a) e - pares o radicales no compartidos
b) electrones de enlace pi
6. Reconocer receptores de electrones
a) átomos con una carga positiva (+)
b) átomos electronegativos que pueden tolerar una carga negativa
c) átomos que poseen electrones deslocalizables - ver #4 arriba
7. Patrones de flujo de electrones comunes
a) mover pi e - hacia carga positiva (+) u otros bonos pi
b) mover los pares e no enlazantes hacia los enlaces pi
c) mover e sin unión simple - hacia enlaces pi
Evaluación de los contribuyentes de resonancia
1. Las estructuras idénticas son igualmente importantes.
2. Las estructuras serán más importantes un mayor número de bonos.
3. Las estructuras con separación de carga son menos importantes.
4. Preste atención a las electronegatividades.
5. Los átomos neutros necesitan tener octetos completos.
Contribuidores de Resonancia para el Grupo
La convención de dibujar dos o más contribuyentes de resonancia para aproximarse a una sola estructura puede parecerle un poco torpe en este punto, pero a medida que adquiera experiencia verá que la práctica es realmente muy útil a la hora de discutir la manera en que reaccionan muchos grupos funcionales. Consideremos a continuación el ion carboxilato (la base conjugada de un ácido carboxílico). Como nuestro ejemplo, usaremos formiato, la molécula que contiene carboxilato más simple posible. El ácido conjugado del formiato es el ácido fórmico, lo que provoca la dolorosa picadura que sentiste si alguna vez te ha mordido una hormiga.
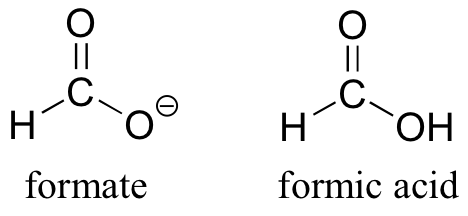
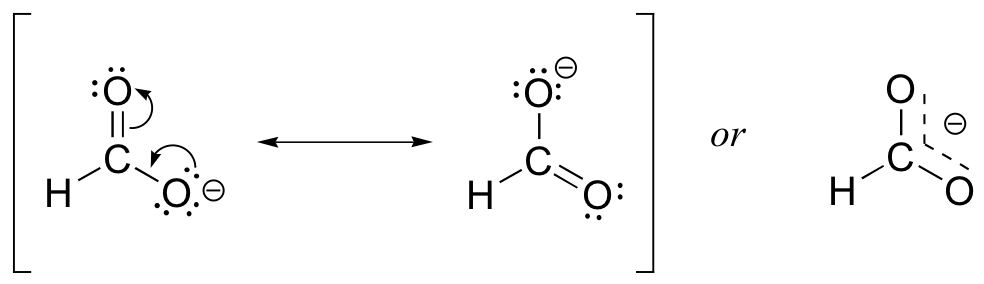
Por lo general, verá grupos carboxilato dibujados con un doble enlace carbono-oxígeno y un enlace sencillo carbono-oxígeno, con una carga formal negativa ubicada en el oxígeno de enlace simple. En la actualidad, sin embargo, los dos enlaces carbono-oxígeno tienen la misma longitud, y aunque efectivamente existe una carga formal negativa general en el grupo, se comparte equitativamente entre los dos oxígenos. Por lo tanto, el carboxilato se puede representar con mayor precisión mediante un par de contribuyentes de resonancia. Alternativamente, se puede usar una sola estructura, con una línea discontinua que representa el enlace pi deslocalizado de resonancia y la carga negativa ubicada entre los dos oxígenos.
Veamos si podemos correlacionar estas convenciones de dibujo con una imagen de la teoría del enlace de valencia de la unión en un grupo carboxilato. Sabemos que el carbono debe ser sp 2 -hibridado, (los ángulos de enlace son cercanos a 120˚, y la molécula es plana), y trataremos ambos oxígenos como sp 2 -hibridados también. Ambos enlaces sigma carbono-oxígeno, entonces, se forman a partir del solapamiento de orbitales de carbono sp 2 y orbitales de oxígeno sp 2.
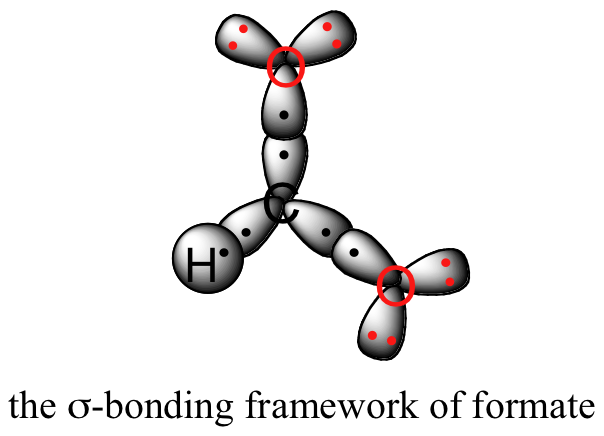
Además, el carbono y ambos oxígenos tienen cada uno un orbital 2 p z no hibridado situado perpendicular al plano de los enlaces sigma. Estos tres orbitales de 2 p z son paralelos entre sí, y pueden superponerse de manera lado a lado para formar un enlace pi deslocalizado.
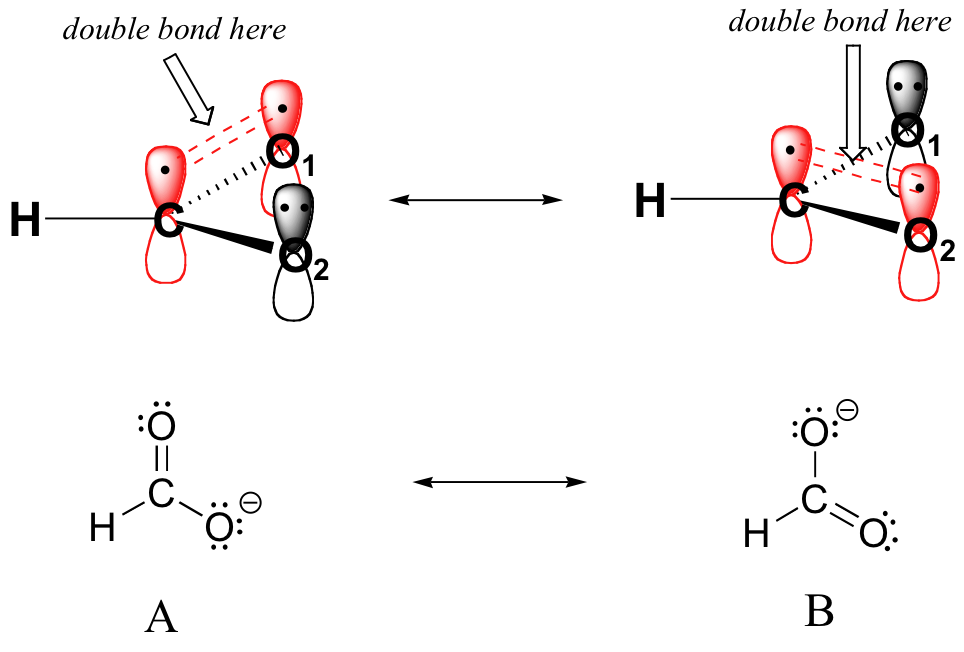
El contribuyente de resonancia A muestra oxígeno #1 compartiendo un par de electrones con carbono en un enlace pi, y oxígeno #2 sosteniendo un par solitario de electrones en su orbital de 2 p z. El contribuyente de resonancia B, por otro lado, muestra oxígeno #2 participando en el enlace pi con carbono, y oxígeno #1 sosteniendo un par solitario en su orbital de 2 p z. En general, la situación es uno de tres orbitales paralelos superpuestos de 2p z que comparten cuatro electrones pi deslocalizados. Debido a que hay un electrón más que los orbitales 2 p z, el sistema tiene una carga general de —1. Este es el tipo de imagen 3D que los contribuyentes de resonancia se utilizan para aproximar, y una vez que obtengas algo de práctica deberías poder visualizar rápidamente orbitales superpuestos de 2 p z y electrones pi deslocalizados cada vez que veas que se utilizan estructuras de resonancia. En este texto, los grupos carboxilato generalmente se dibujarán mostrando solo un contribuyente de resonancia en aras de la simplicidad, pero siempre debes tener en cuenta que los dos enlaces C-O son iguales, y que la carga negativa se deslocaliza a ambos oxígenos.

