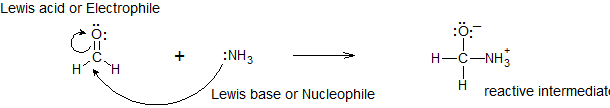1.12: Ácidos y bases de Lewis
- Page ID
- 75907
Objetivo de aprendizaje
- Utilizar la definición de ácidos y bases de Lewis para reconocer el movimiento de electrones en las reacciones
Los ácidos y bases son una parte importante de la química. Una de las teorías más aplicables es el motivo ácido/base de Lewis que extiende la definición de un ácido y una base más allá de los iones H + y OH - como describen los ácidos y bases de Brønsted-Lowry.
Introducción
La teoría ácido-base de Brø nsted se ha utilizado a lo largo de la historia de la química ácida y básica. Sin embargo, esta teoría es muy restrictiva y se centra principalmente en ácidos y bases que actúan como donantes y aceptores de protones. A veces surgen condiciones donde la teoría no encaja necesariamente, como en sólidos y gases. En 1923, G.N. Lewis de UC Berkeley propuso una teoría alternativa para describir ácidos y bases. Su teoría dio una explicación generalizada de ácidos y bases basada en la estructura y la unión. A través del uso de la definición de Lewis de ácidos y bases, los químicos ahora son capaces de predecir una variedad más amplia de reacciones ácido-base. La teoría de Lewis utilizó electrones en lugar de transferencia de protones y específicamente declaró que un ácido es una especie que acepta un par de electrones mientras que una base dona un par de electrones.
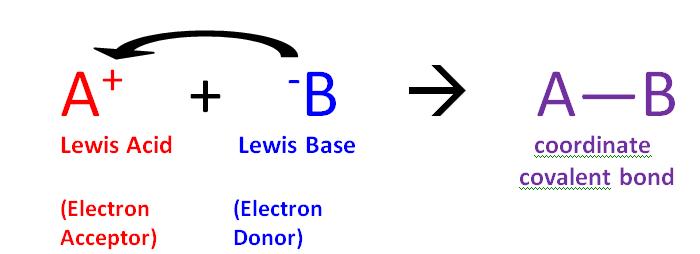
La reacción de un ácido de Lewis y una base de Lewis producirá un enlace covalente coordinado, como se muestra en la Figura\(\PageIndex{1}\) anterior. Un enlace covalente coordinado es solo un tipo de enlace covalente en el que un reactivo le da par de electrones a otro reactivo. En este caso la base lewis dona sus electrones al ácido de Lewis. Cuando reaccionan de esta manera, el producto resultante se llama un compuesto de adición, o más comúnmente un aducto.
- Ácido de Lewis: una especie que acepta un par de electrones (es decir, un electrófilo) y tendrá orbitales vacíos
- Base Lewis: una especie que dona un par de electrones (es decir, un nucleófilo) y tendrá electrones de pares solidos
Ácidos de Lewis
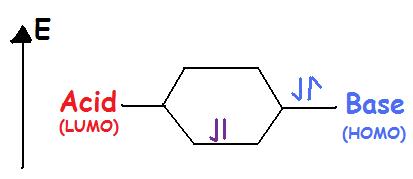
Los ácidos de Lewis aceptan un par de electrones. Los ácidos de Lewis son electrofílicos, lo que significa que atraen electrones. Al unirse con una base el ácido utiliza su orbital molecular desocupado más bajo o LUMO (Figura 2).
- Diversas especies pueden actuar como ácidos de Lewis. Todos los cationes son ácidos de Lewis ya que son capaces de aceptar electrones. (por ejemplo, Cu 2 +, Fe 2 +, Fe 3 +)
- Un átomo, ion o molécula con un octeto incompleto de electrones puede actuar como un ácido de Lewis (por ejemplo, BF 3, AlF 3).
- Las moléculas donde el átomo central puede tener más de 8 electrones de envoltura de valencia pueden ser aceptores de electrones, y por lo tanto se clasifican como ácidos de Lewis (por ejemplo, SiBr 4, SiF 4).
- Moléculas que tienen múltiples enlaces entre dos átomos de diferentes electronegatividades (por ejemplo, CO 2, SO 2)
Bases Lewis
Lewis Bases donan un par de electrones. Las bases de Lewis son nucleofílicas, lo que significa que “atacan” una carga positiva con su pareja solitaria. Ellos utilizan el orbital molecular más alto ocupado o HOMO (Figura 2). Por lo tanto, un átomo, ion o molécula con un par de electrones solidos puede ser una base de Lewis. Cada uno de los siguientes aniones puede “ceder” sus electrones a un ácido, e.g.\(OH^-\),\(CN^-\),\(CH_3COO^-\),\(:NH_3\),\(H_2O:\),\(CO:\). HOMO de la base de Lewis (orbital molecular ocupado más alto) interactúa con el LUMO del ácido de Lewis (orbital molecular desocupado más bajo) para crear orbitales moleculares unidos. Tanto los Ácidos de Lewis como las Bases contienen HOMO y LUMO pero solo el HOMO se considera para Bases y solo el LUMO se considera para los Ácidos (Figura\(\PageIndex{2}\)).
Compuestos complejos de iones/coordinación
Los iones complejos son iones poliatómicos, que se forman a partir de un ion metálico central que tiene otros iones más pequeños unidos a su alrededor. Si bien la teoría de Brønsted no puede explicar esta reacción, la teoría ácido-base de Lewis puede ayudar. Una base de Lewis es a menudo el ligando de un compuesto de coordinación con el metal que actúa como el ácido de Lewis (ver Estados de oxidación de los metales de transición).
\[Al^{3+} + 6 H_2O \rightleftharpoons [Al(H_2O)_6]^{3+} \label{1}\]
El ion aluminio es el metal y es un catión con una capa de valencia sin llenar, y es un ácido de Lewis. El agua tiene electrones de par solitario y es un anión, por lo tanto es una Base Lewis.
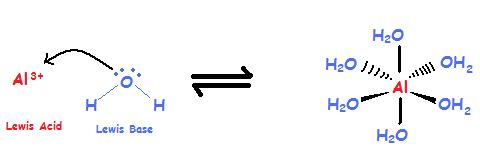
El ácido de Lewis acepta los electrones de la Base Lewis que dona los electrones. Otro caso donde la teoría ácido-base de Lewis puede explicar el compuesto resultante es la reacción del amoníaco con Zn 2 +.
\[ Zn^{2+} + 4NH_3 \rightarrow [Zn(NH_3)_4]^{4+} \label{2}\]
De manera similar, el Ácido de Lewis es el Ion de zinc y la Base de Lewis es NH 3. Observe cómo la Teoría de los Ácidos y Bases de Brønsted no podrá explicar cómo ocurre esta reacción porque no hay\(OH^-\) iones\(H^+\) o involucrados. Así, Lewis Acid and Base Theory permite explicar la formación de otras especies e iones complejos que normalmente no contienen iones hidronio o hidróxido. Uno es capaz de ampliar la definición de un ácido y una base a través de la teoría de ácidos y bases de Lewis. La falta de\(H^+\) o\(OH^-\) iones en muchos iones complejos puede dificultar la identificación de qué especie es un ácido y cuál es una base. Por lo tanto, al definir una especie que dona un par de electrones y una especie que acepta un par de electrones, se expande la definición de un ácido y una base.
Anfoterismo
A partir de ahora debes saber que los ácidos y las bases se distinguen como dos cosas separadas sin embargo algunas sustancias pueden ser tanto un ácido como una base. Es posible que hayas notado esto con agua, que puede actuar tanto como ácido como base. Esta capacidad del agua para hacer esto la convierte en una molécula anfótera. El agua puede actuar como un ácido donando su protón a la base y convirtiéndose así en su ácido conjugado, OH-. Sin embargo, el agua también puede actuar como base aceptando un protón de un ácido para convertirse en su base conjugada, H 3 O +.
- Agua que actúa como un ácido:
\[H_2O + NH_3 \rightarrow NH_4^+ + OH^- \label{3}\]
- Agua que actúa como Base:
\[H_2O + HCl \rightarrow Cl^- + H_3O^+ \label{4}\]
Es posible que hayas notado que el grado en que actúa una molécula depende del medio en el que se haya colocado la molécula. El agua no actúa como ácido en un medio ácido y no actúa como base en un medio básico. Así, el medio en el que se coloca una molécula tiene un efecto sobre las propiedades de esa molécula. Otras moléculas también pueden actuar como un ácido o una base. Por ejemplo,
\[Al(OH)_3 + 3H^+ \rightarrow Al^{3+} + 3H_2O \label{5}\]
- donde Al (OH) 3 está actuando como Base Lewis.
\[Al(OH)_3 + OH^- \rightarrow Al(OH)_4^- \label{6}\]
- donde Al (OH) 3 está actuando como un ácido de Lewis.
Observe cómo las propiedades anfóteras del Al (OH) 3 dependen del tipo de ambiente en el que se haya colocado esa molécula.
Bases y ácidos de Lewis como nucleófilos y electrófilos
El énfasis en el flujo de electrones en la Teoría de Lewis de ácidos y bases es una base importante para aprender y predecir los mecanismos de reacción. La base de Lewis rica en electrones puede describirse como un nucleófilo. Los nucleófilos son atraídos y pueden reaccionar con compuestos o iones que tienen carga positiva total o parcial (como el núcleo). Los ácidos de Lewis pobres en electrones pueden describirse como electrófilos. Los electrófilos atraen a los nucleófilos hasta que se produce un solapamiento orbital entre ellos desencadenando una reacción. En este punto del curso, podemos indicar el flujo de electrones usando flechas curvas cuando se dan tanto el reactivo (es) como el producto (s).
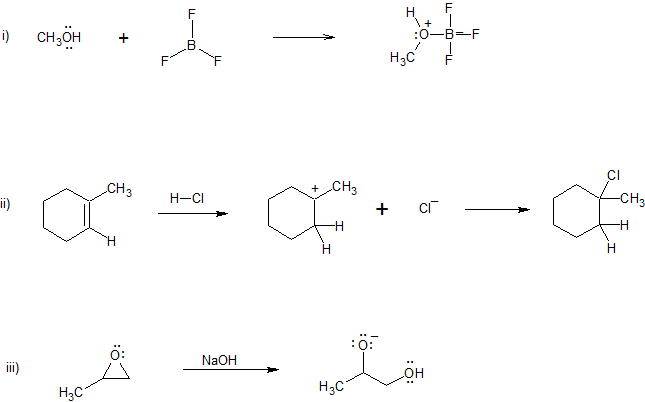
Ejemplo
Ejercicios
Para las siguientes reacciones,
a) agregar flechas curvas para indicar el flujo de electrones
b) marcar cada reactivo como el Nu (nucleófilo) o E + (electrófilo).
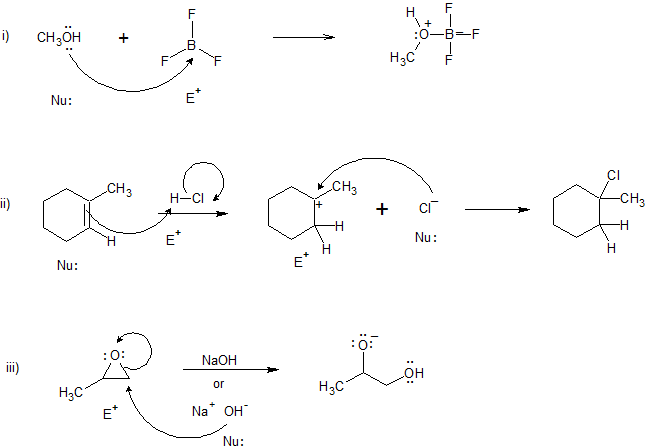
Soluciones
Enlaces externos
- Revisión muy detallada de Ácidos y bases de Lewis, que abarca todos los temas de este tipo de química
- Muy complejo y detallado “Lewis Acid and Base Interaction Matrix”
- Youtube Vídeo sobre Lewis Ácidos/Bases
Referencias
- Cicloadición en Ge (100) del ácido de Lewis AlCl3. Pronto Jung Jung,, Young-Sang Youn,, Hangil Lee,,, Ki-Jeong Kim,,, Bong Soo Kim, y, Sehun Kim,. Revista de la Sociedad Americana de Química 2008 130 (11), 3288-3289
- ¿Máximo de Fluorescencia de 10-Metilacridona? Complejos de sales de iones metálicos: una medida conveniente y cuantitativa de la acidez de Lewis de sales de iones metálicos. Shunichi Fukuzumi y, Kei Ohkubo. Revista de la Sociedad Americana de Química 2002 124 (35), 10270-10271.
- Harwood, William S., F. G. Arenque, Jeffry D. Madura y Ralph H. Petrucci. Principios Generales de Química y Aplicaciones Modernas. 9a ed. Nueva Jersey: Prentice Hall, 2007. 695-96.
Colaboradores y Atribuciones
- Adam Abudra (UCD), Tajinder Badial (UCD)