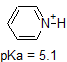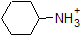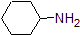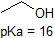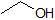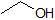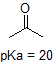1.13: Distinguir entre pH y pKa
- Page ID
- 75946
Objetivo de aprendizaje
- Determinar las fuerzas relativas de ácidos y bases a partir de sus valores de pK a
- Determinar la forma de un ácido o base a un pH especificado (dado el pK a)
La ecuación de Henderson-Hasselbach - una visión cuantitativa
Utilizaremos la reacción general para un ácido débil para escribir la expresión de Ka.
\[HA_{(aq)} + H_2O_{(l)} \rightleftharpoons H_3O^+_{(aq)} + A^-_{(aq)}\]
\[K_a = \dfrac{[H_3O^+][A^-]}{[HA]}\]
pKa = -log Ka
donde cada término entre corchetes representa la concentración de esa sustancia en solución.
Cuanto más fuerte sea un ácido, mayor es la ionización, menor es el pKa y menor es el pH que producirá el compuesto en solución.
Es importante darse cuenta de que pK a no es en absoluto lo mismo que el pH: el primero es una propiedad inherente de un compuesto o grupo funcional, mientras que el segundo es la medida de la concentración de iones hidronio en una solución acuosa particular:
pH = -log [H 3 O +]
Se pueden añadir reactivos adicionales a una solución de reacción para cambiar el pH de las condiciones de reacción más allá de los efectos de un compuesto individual.
Valores de acidez relativa y pKa
Una aplicación de la Ecuación de Henderson-Hasselbach es la capacidad de determinar la acidez relativa de los compuestos comparando sus valores de pKa. Cuanto más fuerte sea un ácido, mayor es la ionización, menor es el pKa y menor es el pH que producirá el compuesto en solución. A continuación se muestran algunos valores de pKa seleccionados para los compuestos en el estudio de la química orgánica. Dado que las reacciones orgánicas se pueden realizar en ambientes no acuosos, el pH puede superar 14 y los compuestos orgánicos pueden tener valores de pKa superiores a 16. Es una variación en esa línea del Mago de Oz, “Ya no vivimos en el agua”.

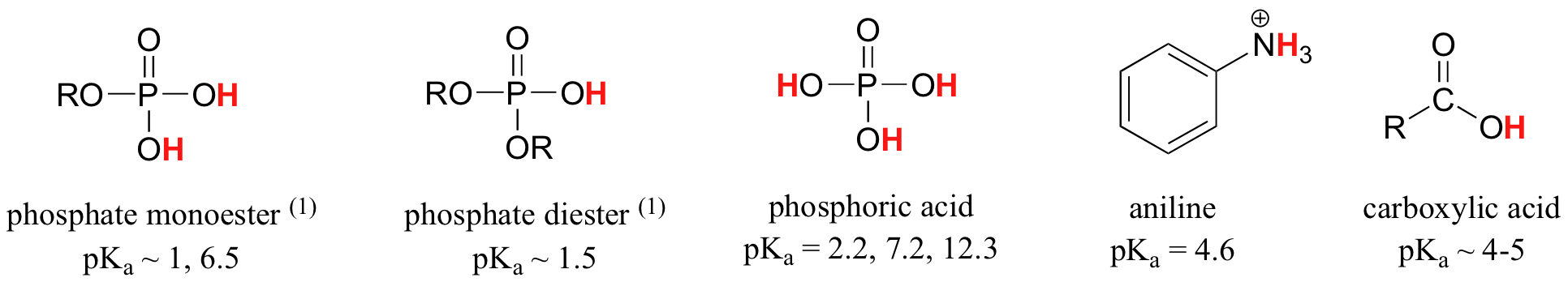



Es una muy buena idea comprometerse a la memoria los rangos de pK a aproximados de los compuestos anteriores. Una palabra de precaución: cuando use la tabla pK a, esté absolutamente seguro de que está considerando el par ácido y base conjugado correcto. Si se le pide que diga algo sobre la basicidad del amoníaco (NH 3) en comparación con la del ion etóxido (CH 3 CH 2 O -), por ejemplo, los valores pK a relevantes a considerar son 9.2 (el pK a del ion amonio) y 16 (el pK a de etanol). A partir de estos números, se sabe que el etóxido es la base más fuerte. No cometas el error de usar el pK un valor de 38: este es el pK a de amoníaco que actúa como un ácido, y te dice lo básico que es el NH 2 - ion (¡muy básico!)
* Una nota sobre el pKa del agua: El pKa del agua es 14. Los textos de bioquímica y química orgánica suelen enumerar el valor como 15.7. Estos textos han factorizado incorrectamente el valor molar de la concentración de agua en la constante de equilibrio. La correcta derivación de la constante de equilibrio implica la actividad del agua, que tiene un valor de 1.
Ejemplo
Si bien este curso comienza con grupos funcionales individuales, eventualmente trabajaremos con compuestos interesantes que contienen múltiples grupos funcionales. Reconocer qué hidrógenos pueden ionizarse como protones ácidos y cuales hidrógenos NO pueden ser ionizados, es una habilidad útil. Observe en este ejemplo que necesitamos evaluar la acidez potencial en cuatro ubicaciones diferentes de la molécula.
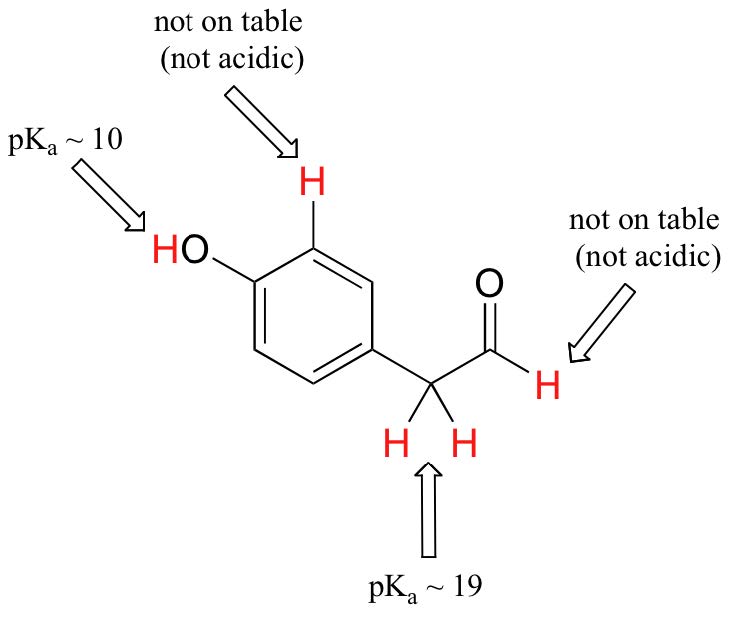
El aldehído y los protones aromáticos no son en absoluto ácidos (los valores de pK a están por encima de 40, no en nuestra tabla). Los dos protones sobre el carbono junto al carbonilo son ligeramente ácidos, con valores de pK a alrededor de 19-20 según la tabla. El protón más ácido está en el grupo fenol, por lo que si el compuesto se sometiera a un solo equivalente molar de base fuerte, este es el protón que se donaría.
Ambientes ácidos y básicos: todo es relativo en reactividad
Debido a que nuestro objetivo es comprender la reactividad química dinámica, NO necesitamos conocer la cantidad específica de las formas protonadas y no protonadas de un compuesto. Simplemente necesitamos saber qué forma es la que predomina. Cuando el pH del ambiente es menor que el pKa del compuesto, el ambiente se considera ácido y el compuesto existirá predominantemente en su forma protonada. Cuando el pH del ambiente es mayor que el pKa del compuesto, el ambiente se considera básico y el compuesto existirá predominantemente en su forma desprotonada.
Por ejemplo, el pKa del ácido acético es de aproximadamente 5. A un pH de 1, el ambiente se considera ácido y el ácido acético existe predominantemente en su forma protonada. A pH 8, el ambiente se considera básico, y el ácido acético se desprotonó para formar acetato (CH 3 CO 2 -). Por el contrario, el pKa del fenol es de 10. A pH 8, el ambiente se considera ácido para el fenol y permanece principalmente protonado.
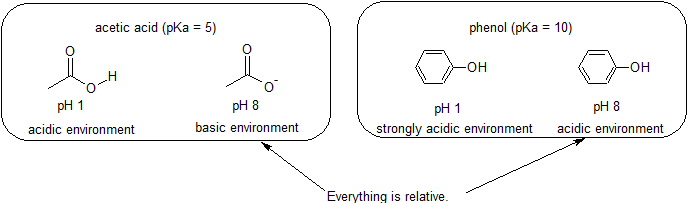
También es importante recordar que la química orgánica NO tiene que ocurrir en el agua por lo que los valores de pKa pueden ser tan altos como 50.
Ejercicio
1. Complete la siguiente tabla para indicar si cada compuesto existe predominantemente en su forma protonada (ambiente ácido) o desprotonada (ambiente básico).
| compuesto (pKa) | Ambiente pH 1 | Ambiente pH 8 | Ambiente pH 13 |
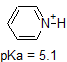 |
|||
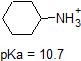 |
|||
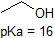 |
|||
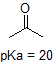 |
- Contestar
- 1.
-
compuesto (pKa) Ambiente pH 1 Ambiente pH 8 Ambiente pH 13