1.17: Soluciones a ejercicios adicionales
- Page ID
- 75867
Formación de Vínculos: La Regla del Octeto
1-1:
a) 6 v.e./2 enlaces covalentes
b) 4 v.e./4 enlaces covalentes
c) 7 v.e./1 enlace covalente
d) 6 v.e./2 enlaces covalentes (también pueden expandir el octeto para formar 6 enlaces covalentes)
e) 1 v.e./1 enlace covalente
f) 3 v.e./3 enlaces covalentes
1-2:
d) K +
1-3:
1-4:
(c) PCl
Estructuras de Lewis
1-5:
1-6:
a) Neón, 8 electrones de valencia
b) Magnesio, 2 electrones de valencia
c) Oxígeno, 6 electrones de valencia
d) Bromo, 7 electrones de valencia
1-7:
1-8:
1-9: C.
Electronegatividad y Polaridad de Enlace
1-10:
1-11:
a) sin momento dipolo flecha b/c no polar
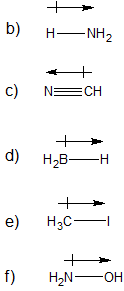
Cargos Formales
1-12:
1-13:
a) 0
b) -1
c) -2
1-14:
a) 0
b) -1
c) 0
d) +1
Estructuras Iónicas
1-15:
a) Na + y Cl -
b) Mg +2 y 2 Br -
c) K + y NO 3 -
d) Na + y H 2 PO 4 -
1-16:
1-17:
a) cianuro de sodio
b) CaC 2 O 4
c) hidróxido de aluminio
d) Sn 3 (PO 4) 2
e) KCLo
Resonancia
1-18:
1-19:
La estructura de resonancia que es más estable tiene el carbocatión terciario. Este carbocatión terciario se estabiliza por hiperconjugación así como dos posibles direcciones de resonancia (en comparación con una estructura de resonancia inmediata para los otros dos carbocationes).
1-20:
1-21:
Al comparar las formas desprotonadas de ácido acético y etanol, acetato y etóxido respectivamente, se puede observar que el acetato deslocaliza la carga negativa sobre todo el grupo carboxilato. El etóxido, sin embargo, solo puede contener la carga negativa sobre el alcóxido, convirtiéndolo en una mejor base, pero peor como ácido.
1-22:
Fórmulas estructurales, moleculares y empíricas
1-23:
1-24:
1-25:
Falso; las fórmulas empíricas son las relaciones de números enteros más simples que son útiles para calcular composiciones porcentuales de átomos en una molécula. Sin embargo, como no dan el número absoluto de átomos en una molécula, no pueden ser utilizados para calcular el peso molecular de la molécula.
1-26:
a) C 2 H 2 O
b) C 4 H 3 N
c) C 9 H 7 NO
Ácidos y Bases - Arrhenius, Bronsted-Lowry y Lewis
1-27:
Arrhenius: Un ácido de Arrhenius es una especie que donará un H+ cuando se disuelva en agua. Una base de Arrhenius es una especie que se descompondrá para producir un OH- cuando se disuelva en agua.
Bronsted-Lowry: Un ácido Bronsted-Lowry es una especie que donará un H+ cuando se disuelva en solución (no solo en agua). Una base Bronsted-Lowry es una especie que puede aceptar un H+ en solución (no solo en agua).
Lewis: Un ácido de Lewis es un aceptor de pares de electrones. Una base de Lewis es un donante de base de electrones.
1-28:
Ka = 2.4 x 10 1
1-29:
H 3 O + > HF > NH 4 + > H 2 O
1-30:
NH 2 - > H 2 O > CH 3 COO - > HSO 4 -
1-31:
El Compuesto A es la base más fuerte. El compuesto B es el ácido más fuerte.
1-32:
El grupo A querrá agarrar el H + más que el grupo B. Dado que C es menos electronegativo que N, tampoco puede estabilizar la carga negativa y querrá agarrar un H + para deshacerse de la carga. (agarrar = reaccionar con)

