1.18: Ácidos y bases Brønsted-Lowry (Revisión)
- Page ID
- 75893
objetivo de aprendizaje
- reconocer ácidos y bases
La teoría de los ácidos y bases de Brønsted-Lowry
En 1923, el químico danés Johannes Brønsted y el químico inglés Thomas Lowry propusieron de forma independiente nuevas definiciones para ácidos y bases, unas que se centran en la transferencia de protones. Un ácido de Brønsted-Lowry es cualquier especie que puede donar un protón (H +) a otra molécula. Una base de Brønsted-Lowry es cualquier especie que puede aceptar un protón de otra molécula. En resumen, un ácido de Brønsted-Lowry es un donante de protones (PD), mientras que una base de Brønsted-Lowry es un aceptor de protones (PA).
Un ácido de Brønsted-Lowry es un donante de protones, mientras que una base de Brønsted-Lowry es un aceptor de protones.
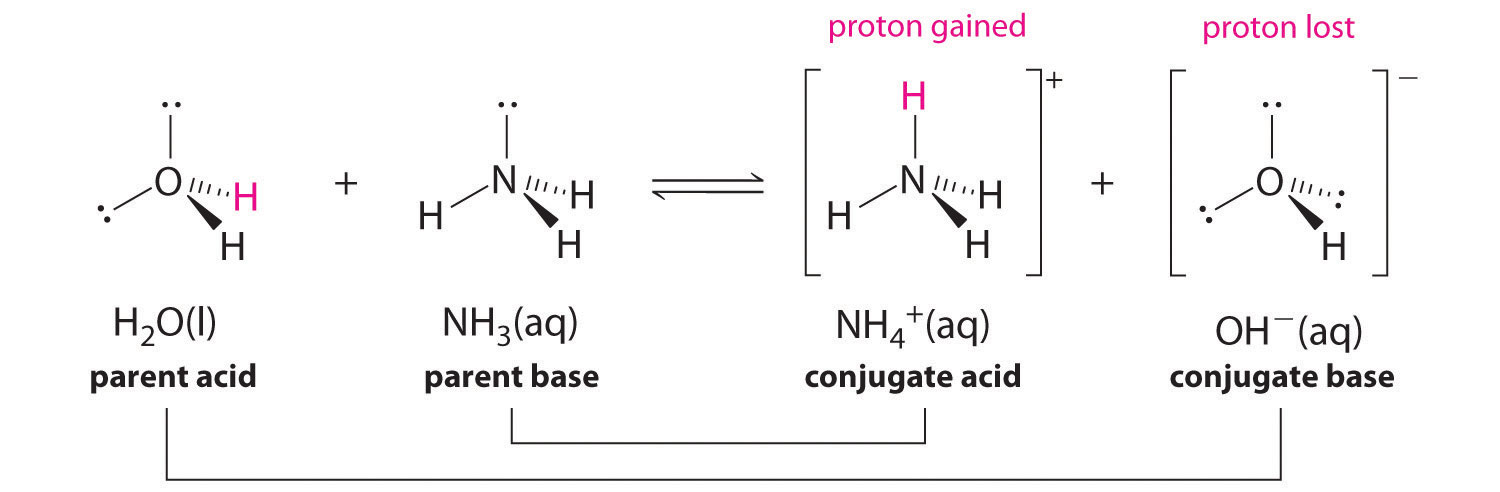
Usemos la reacción del amoníaco en agua para demostrar las definiciones de Brønsted-Lowry de un ácido y una base. Las moléculas de amoníaco y agua son reactivos, mientras que el ión amonio y el ion hidróxido son productos:
\[\ce{NH3(aq) + H2O (ℓ) <=> NH^{+}4(aq) + OH^{−}(aq) }\label{Eq1}\]
Lo que ha ocurrido en esta reacción es que la molécula de agua original ha donado un ión hidrógeno a la molécula de amoníaco original, que a su vez ha aceptado el ión hidrógeno. Podemos ilustrar esto de la siguiente manera:
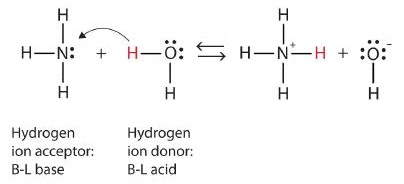
Debido a que la molécula de agua dona un ión de hidrógeno al amoníaco, es el ácido de Brønsted-Lowry, mientras que la molécula de amoníaco, que acepta el ion hidrógeno, es la base de Brønsted-Lowry. Así, el amoníaco actúa como base tanto en el sentido Arrhenius como en el sentido Brønsted-Lowry.
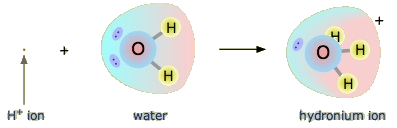
¿Un ácido de Arrhenius como el ácido clorhídrico sigue siendo un ácido en el sentido de Brønsted-Lowry? Sí, pero requiere que entendamos lo que realmente sucede cuando el HCl se disuelve en agua. Recordemos que el átomo de hidrógeno es un solo protón rodeado por un solo electrón. Para hacer el ion hidrógeno, eliminamos el electrón, dejando un protón desnudo. ¿Realmente tenemos protones desnudos flotando en solución acuosa? No, no lo hacemos. Lo que realmente sucede es que el ion H + se adhiere a H 2 O para hacer H 3 O +, que se llama el ion hidronio. Para la mayoría de los propósitos, H + y H 3 O + representan la misma especie, pero escribir H 3 O + en lugar de H + muestra que entendemos que no hay protones desnudos flotando alrededor en solución. Más bien, estos protones están realmente unidos a moléculas solventes.
El iON de hidronio
Un protón en solución acuosa puede estar rodeado por más de una molécula de agua, lo que lleva a fórmulas como\(\ce{H5O2^{+}}\) o más\(\ce{H9O4^{+}}\) bien que\(\ce{H3O^{+}}\). Sin embargo, es más sencillo de usar\(\ce{H3O^{+}}\) para representar el ion hidronio.
Con esto en mente, ¿cómo definimos al HCl como un ácido en el sentido de Brønsted-Lowry? Considera lo que sucede cuando el HCl se disuelve en H 2 O:
\[\ce{HCl(g) + H_2O (ℓ) \rightarrow H_3O^{+}(aq) + Cl^{−}(aq) }\label{Eq2}\]
Podemos representar este proceso usando diagramas de puntos electrónicos de Lewis:
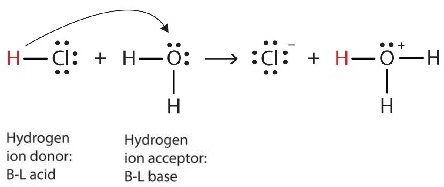
Ahora vemos que un ión hidrógeno se transfiere de la molécula de HCl a la molécula H 2 O para hacer iones cloruro e iones hidronio. Como donador de iones de hidrógeno, el HCl actúa como un ácido de Brønsted-Lowry; como aceptor de iones de hidrógeno, H 2 O es una base de Brønsted-Lowry. Entonces HCl es un ácido no sólo en el sentido Arrhenius sino también en el sentido Brønsted-Lowry. Además, por las definiciones de Brønsted-Lowry, H 2 O es una base en la formación de HCl acuoso. Entonces, las definiciones de Brønsted-Lowry de un ácido y una base clasifican la disolución de HCl en agua como una reacción entre un ácido y una base, aunque la definición de Arrhenius no habría etiquetado a H 2 O como base en esta circunstancia.
- Un ácido de Brønsted-Lowry es un donante de protones (iones de hidrógeno).
- Una base de Brønsted-Lowry es un aceptor de protones (iones de hidrógeno).
- Todos los ácidos y bases de Arrhenius son también ácidos y bases de Brønsted-Lowry. Sin embargo, no todos los ácidos y bases de Brønsted-Lowry son ácidos y bases de Arrhenius.
Ejemplo\(\PageIndex{1}\)
La anilina (C 6 H 5 NH 2) es ligeramente soluble en agua. Tiene un átomo de nitrógeno que puede aceptar un ion hidrógeno de una molécula de agua al igual que lo hace el átomo de nitrógeno en el amoníaco. Escriba la ecuación química para esta reacción e identifique el ácido y base de Brønsted-Lowry.
Solución
C 6 H 5 NH 2 y H 2 O son los reactivos. Cuando C 6 H 5 NH 2 acepta un protón de H 2 O, gana un H extra y una carga positiva y deja atrás un ion OH −. La reacción es la siguiente:
\[\ce{C6H5NH2(aq) + H2O(ℓ) <=> C6H5NH3^{+}(aq) + OH^{−}(aq)} \nonumber\]
Debido a que C 6 H 5 NH 2 acepta un protón, es la base Brønsted-Lowry. La molécula H 2 O, por donar un protón, es el ácido Brønsted-Lowry.
Ejercicio\(\PageIndex{1}\)
Identificar el ácido de Brønsted-Lowry y la base de Brønsted-Lowry en esta ecuación química.
\[\ce{H2PO4^{-} + H_2O <=> HPO4^{2-} + H3O^{+}}\]
- Respuesta:
- Ácido Brønsted-Lowry: H 2 PO 4 -; Base Brønsted-Lowry: H 2 O
Ejercicio\(\PageIndex{2}\)
¿Cuál de los siguientes compuestos es una base Bronsted-Lowry?
- HCl
- HPO 4 2 -
- H 3 PO 4
- NH 4 +
- CH 3 NH 3 +
- Respuesta:
-
Una Base Brønsted-Lowry es un aceptor de protones, lo que significa que tomará en un H +. Esto elimina\(\ce{HCl}\),\(\ce{H3PO4}\),\(\ce{NH4^{+}}\) y\(\ce{CH_3NH_3^{+}}\) porque son ácidos Bronsted-Lowry. Todos regalan protones. En el caso de\(\ce{HPO4^{2-}}\), considere la siguiente ecuación:
\[\ce{HPO4^{2-} (aq) + H2O (l) \rightarrow PO4^{3-} (aq) + H3O^{+}(aq) } \nonumber\]
Aquí, es claro que HPO 4 2 - es el ácido ya que dona un protón al agua para hacer H 3 O + y PO 4 3 -. Consideremos ahora la siguiente ecuación:
\[ \ce{ HPO4^{2-}(aq) + H2O(l) \rightarrow H2PO4^{-} + OH^{-}(aq)} \nonumber\]
En este caso, HPO 4 2 - es la base ya que acepta un protón del agua para formar H 2 PO 4 - y OH -. Así, HPO 4 2 - es un ácido y una base juntos, haciéndola anfótera.
Dado que HPO 4 2 - es el único compuesto de las opciones que puede actuar como base, la respuesta es (b) HPO 4 2-.
Par Acido-Base Conjugado
En realidad, todas las reacciones ácido-base implican la transferencia de protones entre ácidos y bases. Por ejemplo, considere la reacción ácido-base que tiene lugar cuando el amoníaco se disuelve en agua. Una molécula de agua (que funciona como un ácido) transfiere un protón a una molécula de amoníaco (que funciona como una base), dando la base conjugada del agua\(\ce{OH^-}\), y el ácido conjugado del amoníaco,\(\ce{NH4+}\):
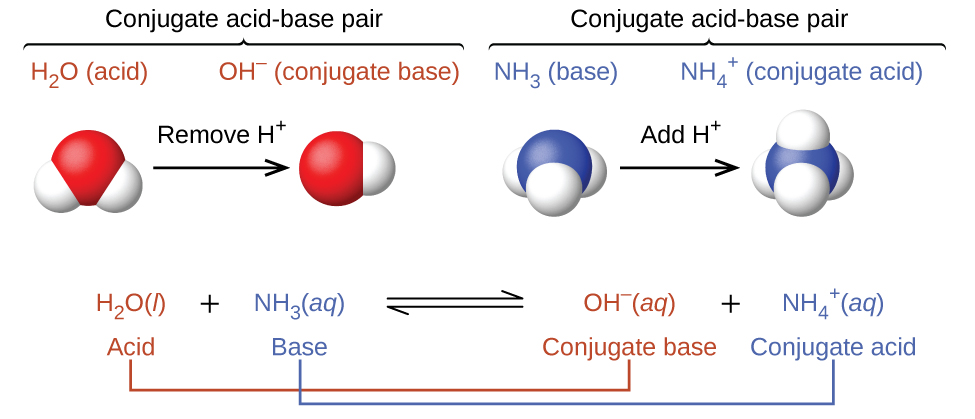
En la reacción del amoníaco con agua para dar iones amonio e iones hidróxido, el amoníaco actúa como base al aceptar un protón de una molécula de agua, lo que en este caso significa que el agua está actuando como un ácido. En la reacción inversa, un ion amonio actúa como un ácido donando un protón a un ion hidróxido, y el ion hidróxido actúa como base. Los pares de ácido-base conjugados para esta reacción son\(NH_4^+/NH_3\) y\(H_2O/OH^−\).
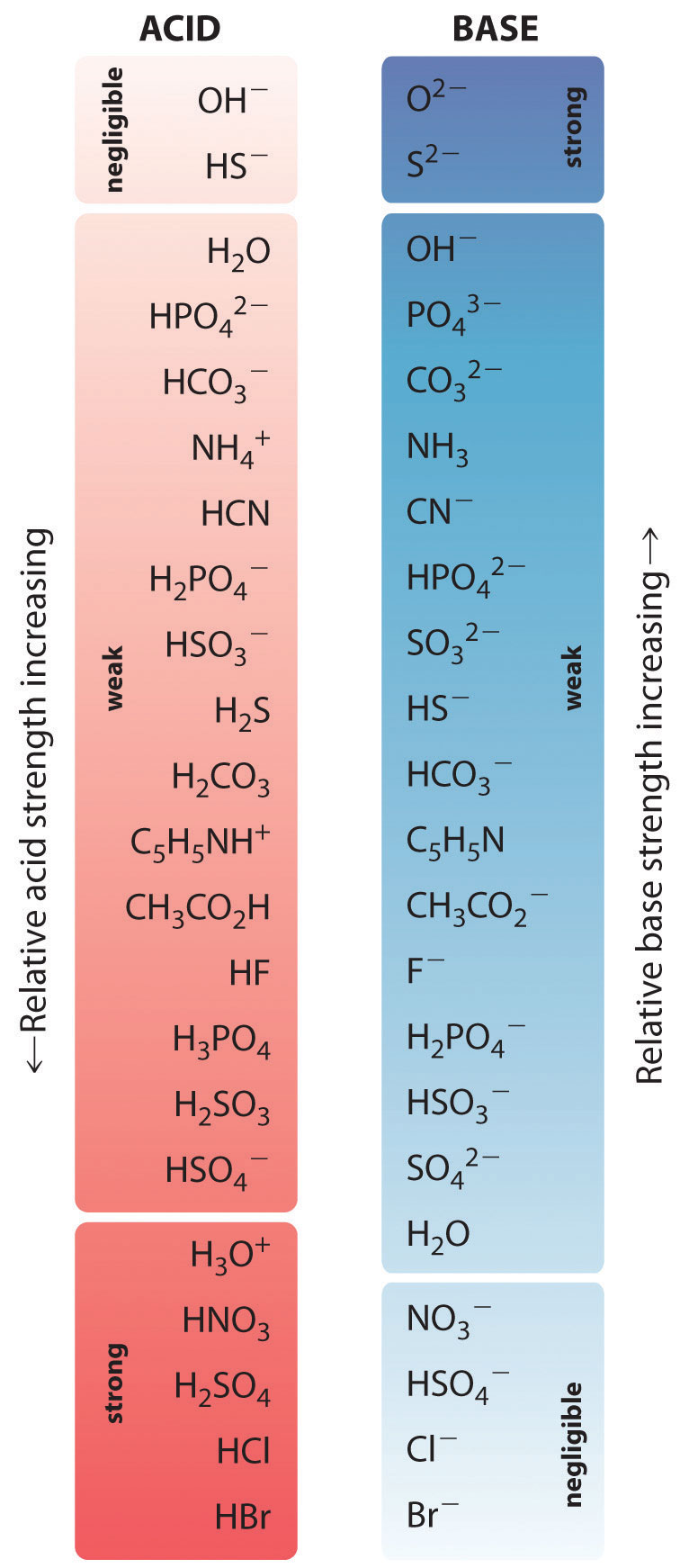
Los ácidos más fuertes están en la parte inferior izquierda, y las bases más fuertes están en la parte superior derecha. La base conjugada de un ácido fuerte es una base muy débil, y, a la inversa, el ácido conjugado de una base fuerte es un ácido muy débil.
Ejemplo\(\PageIndex{2}\)
Identificar los pares ácido-base conjugados en este equilibrio.
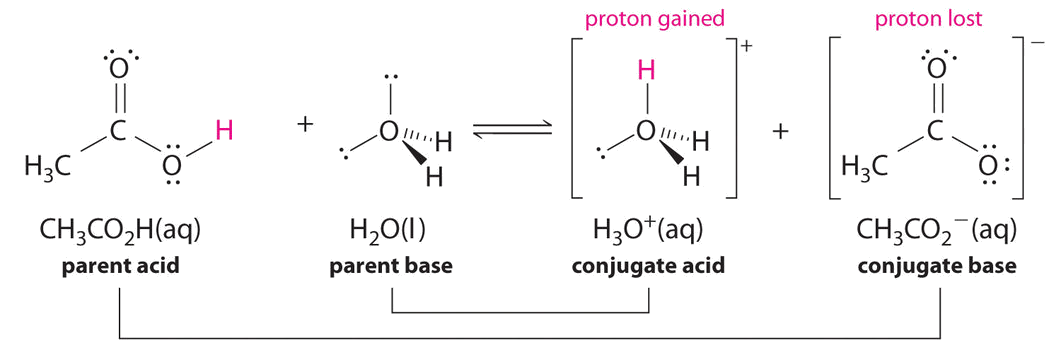
\[\ce{CH3CO2H + H2O <=> H3O^{+} + CH3CO2^{-}} \nonumber\]
Solución
De igual manera, en la reacción del ácido acético con agua, el ácido acético dona un protón al agua, que actúa como base. En la reacción inversa,\(H_3O^+\) se encuentra el ácido que dona un protón al ion acetato, que actúa como base.
Una vez más, tenemos dos pares de ácido-base conjugados:
- el ácido parental y su base conjugada (\(CH_3CO_2H/CH_3CO_2^−\)) y
- la base parental y su ácido conjugado (\(H_3O^+/H_2O\)).
Ejemplo\(\PageIndex{3}\)
Identificar los pares ácido-base conjugados en este equilibrio.
\[(CH_{3})_{3}N + H_{2}O\rightleftharpoons (CH_{3})_{3}NH^{+} + OH^{-} \nonumber\]
Solución
Un par es H 2 O y OH −, donde H 2 O tiene uno más H + y es el ácido conjugado, mientras que OH − tiene uno menos H + y es la base conjugada.
El otro par consiste en (CH 3) 3 N y (CH 3) 3 NH +, donde (CH 3) 3 NH + es el conjugado ácido (tiene un protón adicional) y (CH 3) 3 N es la base conjugada.
Ejercicio\(\PageIndex{3}\)
Identificar los pares ácido-base conjugados en este equilibrio.
\[\ce{NH2^{-} + H2O\rightleftharpoons NH3 + OH^{-}} \nonumber\]
- Respuesta:
- H 2 O (ácido) y OH − (base); NH 2 − (base) y NH 3 (ácido)
Colaboradores y Atribuciones
Henry Agnew (UC Davis)

