2.10: Fuerzas Intermoleculares (IMF) - Revisión
- Page ID
- 76677
objetivo de aprendizaje
- determinar las fuerzas intermoleculares dominantes (IMF) de los compuestos orgánicos
Las propiedades de los líquidos son intermedias entre las de gases y sólidos, pero son más similares a las de los sólidos. A diferencia de las fuerzas intramoleculares, como los enlaces covalentes que mantienen unidos a los átomos en moléculas e iones poliatómicos, las fuerzas intermoleculares mantienen unidas a las moléculas en un líquido o sólido. Las fuerzas intermoleculares son generalmente mucho más débiles que los enlaces covalentes. Por ejemplo, se requieren 927 kJ para superar las fuerzas intramoleculares y romper ambos enlaces O-H en 1 mol de agua, pero solo se necesitan alrededor de 41 kJ para superar las atracciones intermoleculares y convertir 1 mol de agua líquida en vapor de agua a 100°C. (A pesar de este valor aparentemente bajo, las fuerzas intermoleculares en ¡el agua líquida se encuentran entre las fuerzas más fuertes conocidas!) Dada la gran diferencia en las resistencias de las fuerzas intra e intermoleculares, los cambios entre los estados sólido, líquido y gaseoso ocurren casi invariablemente para sustancias moleculares sin romper los enlaces covalentes.
Las propiedades de los líquidos son intermedias entre las de gases y sólidos pero son más similares a las de los sólidos.
Las fuerzas intermoleculares determinan las propiedades de masa tales como los puntos de fusión de los sólidos y los puntos de ebullición de los líquidos. Los líquidos hierven cuando las moléculas tienen suficiente energía térmica para superar las fuerzas atractivas intermoleculares que las mantienen unidas, formando así burbujas de vapor dentro del líquido. De manera similar, los sólidos se funden cuando las moléculas adquieren suficiente energía térmica para superar las fuerzas intermoleculares que los bloquean en su lugar en el sólido.
Las fuerzas intermoleculares son de naturaleza electrostática; es decir, surgen de la interacción entre especies cargadas positiva y negativamente. Al igual que los enlaces covalentes e iónicos, las interacciones intermoleculares son la suma de componentes atractivos y repulsivos. Debido a que las interacciones electrostáticas caen rápidamente al aumentar la distancia entre las moléculas, las interacciones intermoleculares son más importantes para los sólidos y líquidos, donde las moléculas están muy juntas. Estas interacciones se vuelven importantes para los gases solo a presiones muy altas, donde son responsables de las desviaciones observadas de la ley de gases ideal a altas presiones. (Para mayor información sobre el comportamiento de los gases reales y desviaciones de la ley de gas ideal,.)
En esta sección, consideramos explícitamente tres tipos de interacciones intermoleculares: Hay dos tipos adicionales de interacción electrostática con los que ya está familiarizado: las interacciones ión-ion que son responsables de la unión iónica y las interacciones ión-dipolo que ocurren cuando las sustancias iónicas disolverse en una sustancia polar como el agua. Los dos primeros a menudo se describen colectivamente como fuerzas de van der Waals.
Interacciones dipolo-dipolo
Los enlaces covalentes polares se comportan como si los átomos unidos tuvieran cargas fraccionarias localizadas que son iguales pero opuestas (es decir, los dos átomos unidos generan un dipolo). Si la estructura de una molécula es tal que los dipolos de enlace individuales no se cancelan entre sí, entonces la molécula tiene un momento dipolar neto. Las moléculas con momentos dipolares netos tienden a alinearse de manera que el extremo positivo de un dipolo esté cerca del extremo negativo de otro y viceversa, como se muestra en la Figura\(\PageIndex{1a}\).
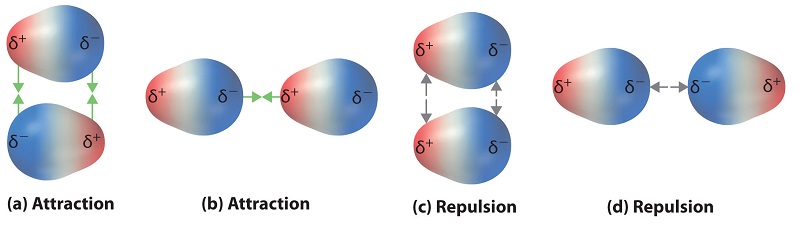
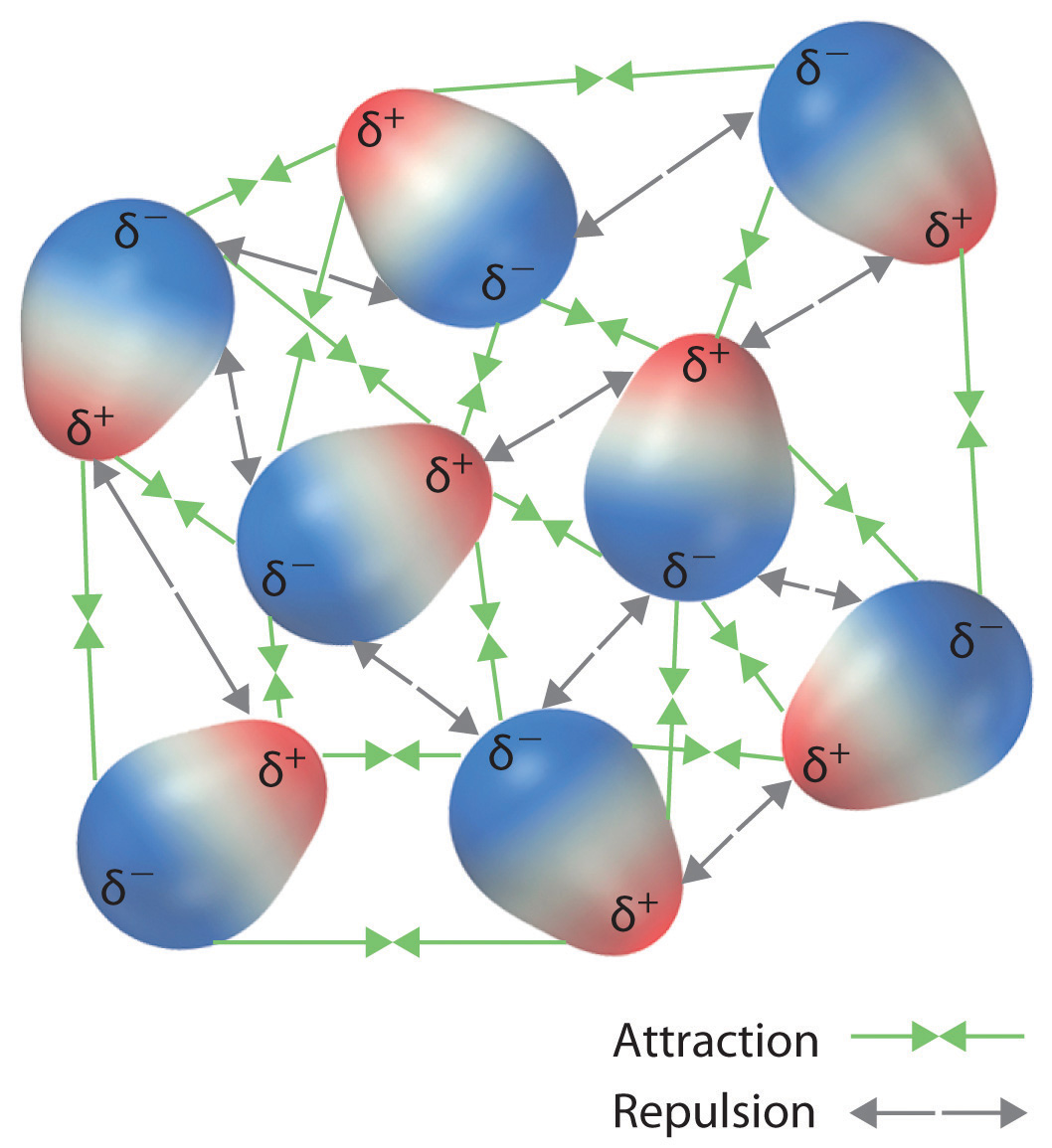
Estas disposiciones son más estables que las disposiciones en las que dos extremos positivos o dos negativos son adyacentes (Figura\(\PageIndex{1c}\)). Por lo tanto, las interacciones dipolo-dipolo, como las de la Figura\(\PageIndex{1b}\), son interacciones intermoleculares atractivas, mientras que las de la Figura\(\PageIndex{1d}\) son interacciones intermoleculares repulsivas. Debido a que las moléculas en un líquido se mueven libre y continuamente, las moléculas siempre experimentan interacciones dipolo-dipolo atractivas y repulsivas simultáneamente, como se muestra en la Figura\(\PageIndex{2}\). En promedio, sin embargo, dominan las interacciones atractivas.
Debido a que cada extremo de un dipolo posee solo una fracción de la carga de un electrón, las interacciones dipolo-dipolo son sustancialmente más débiles que las interacciones entre dos iones, cada uno de los cuales tiene una carga de al menos ±1, o entre un dipolo y un ion, en el que una de las especies tiene al menos un positivo completo o carga negativa. Además, la interacción atractiva entre los dipolos disminuye mucho más rápidamente al aumentar la distancia que las interacciones ion-ion. Recordemos que la energía atractiva entre dos iones es proporcional a 1/ r, donde r es la distancia entre los iones. Duplicar la distancia (r → 2 r) disminuye la energía atractiva a la mitad. En contraste, la energía de la interacción de dos dipolos es proporcional a 1/ r 3, por lo que duplicar la distancia entre los dipolos disminuye la fuerza de la interacción en 2 3, o 8 veces. Así, una sustancia como\(\ce{HCl}\), que se mantiene parcialmente unida por interacciones dipolo-dipolo, es un gas a temperatura ambiente y 1 atm de presión, mientras que\(\ce{NaCl}\), que se mantiene unida por interacciones interiónicas, es un sólido de alto punto de fusión. Dentro de una serie de compuestos de masa molar similar, la fuerza de las interacciones intermoleculares aumenta a medida que aumenta el momento dipolar de las moléculas, como se muestra en la Tabla\(\PageIndex{1}\).
| Compuesto | Masa molar (g/mol) | Momento dipolo (D) | Punto de ebullición (K) |
|---|---|---|---|
| C 3 H 6 (ciclopropano) | 42 | 0 | 240 |
| CH 3 OCH 3 (éter dimetílico) | 46 | 1.30 | 248 |
| CH 3 CN (acetonitrilo) | 41 | 3.9 | 355 |
La energía atractiva entre dos iones es proporcional a 1/r, mientras que la energía atractiva entre dos dipolos es proporcional a 1/r6.
Ejemplo
Organizar éter etílico metílico (CH 3 OCH 2 CH 3), 2-metilpropano [isobutano, (CH 3) 2 CHCH 3] y acetona (CH 3 COCH 3) en orden de aumentar los puntos de ebullición. Sus estructuras son las siguientes:
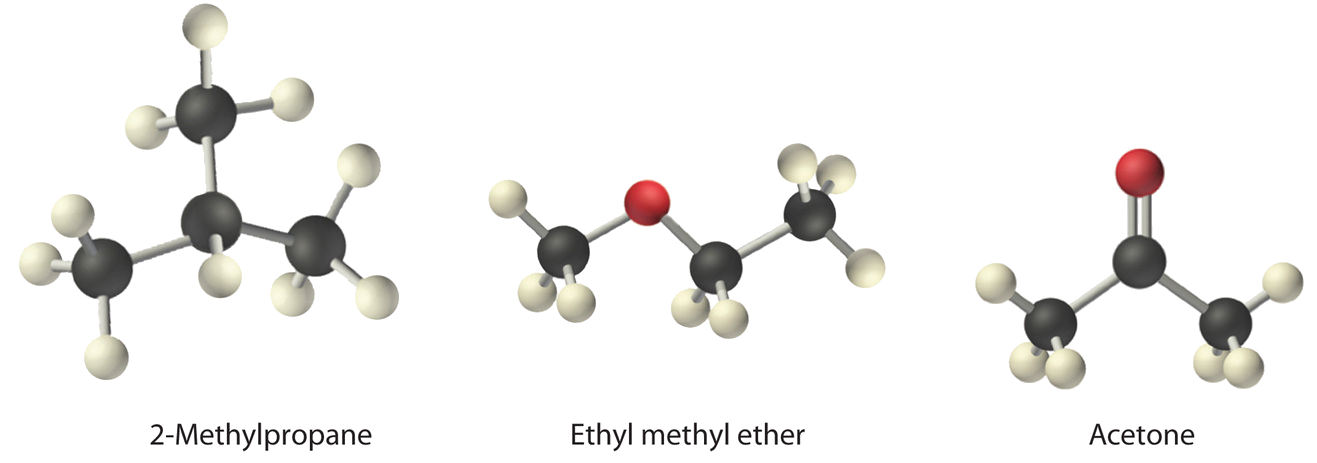
Dado: compuestos
Preguntado por: orden de aumentar los puntos de ebullición
Estrategia:
Comparar las masas molares y las polaridades de los compuestos. Los compuestos con masas molares más altas y que sean polares tendrán los puntos de ebullición más altos.
Solución:
Los tres compuestos tienen esencialmente la misma masa molar (58—60 g/mol), por lo que debemos observar las diferencias de polaridad para predecir la fuerza de las interacciones intermoleculares dipolo-dipolo y así los puntos de ebullición de los compuestos.
El primer compuesto, 2-metilpropano, contiene solo enlaces C—H, los cuales no son muy polares porque C y H tienen electronegatividades similares. Por lo tanto, debe tener un momento dipolar muy pequeño (pero distinto de cero) y un punto de ebullición muy bajo.
El éter etílico metílico tiene una estructura similar a H 2 O; contiene dos enlaces simples C—O polares orientados en un ángulo de aproximadamente 109° entre sí, además de enlaces C—H relativamente no polares. Como resultado, los dipolos de enlace C-O se refuerzan parcialmente entre sí y generan un momento dipolar significativo que debería dar un punto de ebullición moderadamente alto.
La acetona contiene un doble enlace polar C=O orientado a aproximadamente 120° a dos grupos metilo con enlaces C—H no polares. Por lo tanto, el dipolo de enlace C-O corresponde al dipolo molecular, lo que debería resultar en un momento dipolar bastante grande y un punto de ebullición alto.
Así predecimos el siguiente orden de puntos de ebullición:
2-metilpropano < etil metil éter < acetona.
Este resultado está en buena concordancia con los datos reales: 2-metilpropano, punto de ebullición = −11.7°C, y el momento dipolar (μ) = 0.13 D; metil etil éter, punto de ebullición = 7.4°C y μ = 1.17 D; acetona, punto de ebullición = 56.1°C y μ = 2.88 D.
Ejercicio
Disponer tetrafluoruro de carbono (CF 4), sulfuro de etilo y metilo (CH 3 SC 2 H 5), dimetilsulfóxido [(CH 3) 2 S=O] y 2-metilbutano [isopentano, (CH 3) 2 CHCH 2 CH 3] en orden decreciente puntos de ebullición.
- Contestar
-
dimetilsulfóxido (punto de ebullición = 189.9°C) > etil metil sulfuro (punto de ebullición = 67°C) > 2-metilbutano (punto de ebullición = 27.8°C) > tetrafluoruro de carbono (punto de ebullición = −128°C)
Fuerzas de dispersión de Londres
Hasta ahora hemos considerado solo interacciones entre moléculas polares, pero hay que considerar otros factores para explicar por qué muchas moléculas no polares, como el bromo, el benceno y el hexano, son líquidos a temperatura ambiente, y otras, como el yodo y el naftaleno, son sólidos. Incluso los gases nobles pueden licuarse o solidificarse a bajas temperaturas, altas presiones, o ambas (Tabla\(\PageIndex{2}\)).
¿Qué tipo de fuerzas atractivas pueden existir entre moléculas o átomos no polares? Esta pregunta fue respondida por Fritz London (1900—1954), un físico alemán que más tarde trabajó en Estados Unidos. En 1930, Londres propuso que las fluctuaciones temporales en las distribuciones de electrones dentro de átomos y moléculas no polares podrían resultar en la formación de momentos dipolares instantáneos de corta duración, que producen fuerzas atractivas llamadas fuerzas de dispersión londinenses entre sustancias que de otro modo serían no polares.
| Sustancia | Masa molar (g/mol) | Punto de fusión (°C) | Punto de ebullición (°C) |
|---|---|---|---|
| Ar | 40 | −189.4 | −185.9 |
| Xe | 131 | −111.8 | −108.1 |
| N 2 | 28 | −210 | −195.8 |
| O 2 | 32 | −218.8 | −183.0 |
| F 2 | 38 | −219.7 | −188.1 |
| I 2 | 254 | 113.7 | 184.4 |
| CH 4 | 16 | −182.5 | −161.5 |
Considera un par de átomos de He adyacentes, por ejemplo. En promedio, los dos electrones en cada átomo de He están distribuidos uniformemente alrededor del núcleo. Debido a que los electrones están en constante movimiento, sin embargo, su distribución en un átomo es probable que sea asimétrica en cualquier instante dado, resultando en un momento dipolar instantáneo. Como se muestra en la parte (a) de la Figura\(\PageIndex{3}\), el momento dipolar instantáneo en un átomo puede interactuar con los electrones en un átomo adyacente, tirando de ellos hacia el extremo positivo del dipolo instantáneo o repeléndolos del extremo negativo. El efecto neto es que el primer átomo provoca la formación temporal de un dipolo, llamado dipolo inducido, en el segundo. Las interacciones entre estos dipolos temporales hacen que los átomos se atraigan entre sí. Estas interacciones atractivas son débiles y caen rápidamente con el aumento de la distancia. Londres pudo demostrar con mecánica cuántica que la energía atractiva entre las moléculas debido a las interacciones dipolo inducidas por dipolo temporal cae como 1/ r 6. Duplicar la distancia, por lo tanto, disminuye la energía atractiva en 2 6, o 64 veces.
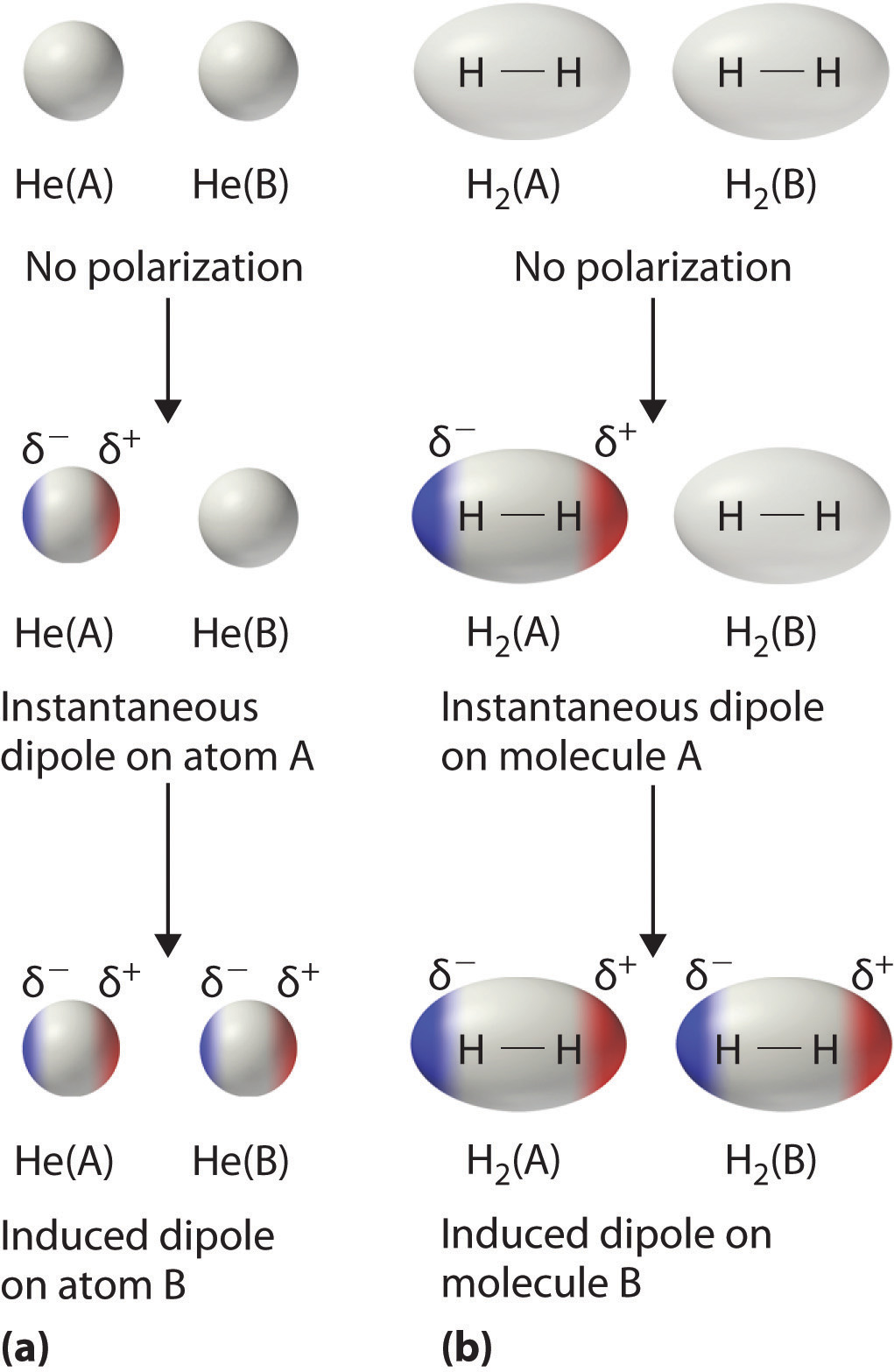
Las interacciones dipolares inducidas por dipolos instantáneos entre moléculas no polares pueden producir atracciones intermoleculares del mismo modo que producen atracciones interatómicas en sustancias monatómicas como Xe. Este efecto, ilustrado para dos moléculas H 2 en la parte (b) en la Figura\(\PageIndex{3}\), tiende a hacerse más pronunciado a medida que aumentan las masas atómicas y moleculares (Tabla\(\PageIndex{2}\)). Por ejemplo, Xe hierve a −108.1°C, mientras que Él hierve a −269°C. La razón de esta tendencia es que la fuerza de las fuerzas de dispersión de Londres está relacionada con la facilidad con la que se puede perturbar la distribución de electrones en un átomo dado. En átomos pequeños como He, los dos electrones de 1 s se mantienen cerca del núcleo en un volumen muy pequeño, y las repulsiones electrón-electrón son lo suficientemente fuertes como para evitar una asimetría significativa en su distribución. En átomos más grandes como Xe, sin embargo, los electrones externos son mucho menos fuertemente atraídos hacia el núcleo debido a las conchas intervinientes rellenas. Como resultado, es relativamente fácil deformar temporalmente la distribución de electrones para generar un dipolo instantáneo o inducido. La facilidad de deformación de la distribución electrónica en un átomo o molécula se llama su polarizabilidad. Debido a que la distribución de electrones se perturbe más fácilmente en especies grandes y pesadas que en especies pequeñas y ligeras, decimos que las sustancias más pesadas tienden a ser mucho más polarizables que las más ligeras.
Para sustancias similares, las fuerzas de dispersión de Londres se vuelven más fuertes al aumentar el tamaño molecular.
La polarizabilidad de una sustancia también determina cómo interactúa con iones y especies que poseen dipolos permanentes. Así, las fuerzas de dispersión de Londres son responsables de la tendencia general hacia puntos de ebullición más altos con mayor masa molecular y mayor área superficial en una serie homóloga de compuestos, como los alcanos (parte (a) en la Figura\(\PageIndex{4}\)). Las fortalezas de las fuerzas de dispersión de Londres también dependen significativamente de la forma molecular porque la forma determina la cantidad de una molécula que puede interactuar con sus moléculas vecinas en un momento dado. Por ejemplo, la parte (b) de la Figura\(\PageIndex{4}\) muestra 2,2-dimetilpropano (neopentano) y n-pentano, los cuales tienen la fórmula empírica C 5 H 12. El neopentano es casi esférico, con una pequeña superficie para interacciones intermoleculares, mientras que el n-pentano tiene una conformación extendida que le permite entrar en contacto cercano con otras moléculas de n-pentano. Como resultado, el punto de ebullición del neopentano (9.5°C) es más de 25°C menor que el punto de ebullición del n-pentano (36.1°C).
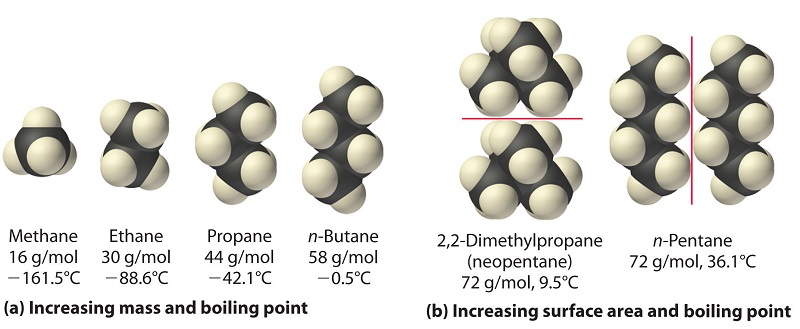
Todas las moléculas, sean polares o no polares, son atraídas entre sí por las fuerzas de dispersión de Londres además de cualquier otra fuerza atractiva que pueda estar presente. En general, sin embargo, las interacciones dipolo-dipolo en moléculas polares pequeñas son significativamente más fuertes que las fuerzas de dispersión de Londres, por lo que predominan las primeras.
Ejemplo
Organizar n-butano, propano, 2-metilpropano [isobuteno, (CH 3) 2 CHCH 3] y n-pentano en orden de aumentar los puntos de ebullición.
Dado: compuestos
Preguntado por: orden de aumentar los puntos de ebullición
Estrategia:
Determinar las fuerzas intermoleculares en los compuestos y luego organizar los compuestos de acuerdo con la fuerza de esas fuerzas. La sustancia con las fuerzas más débiles tendrá el punto de ebullición más bajo.
Solución:
Los cuatro compuestos son alcanos y no polares, por lo que las fuerzas de dispersión de Londres son las únicas fuerzas intermoleculares importantes. Estas fuerzas son generalmente más fuertes con el aumento de la masa molecular, por lo que el propano debe tener el punto de ebullición más bajo y el n-pentano debería tener el más alto, con los dos isómeros de butano cayendo en el medio. De los dos isómeros de butano, el 2-metilpropano es más compacto y el n-butano tiene la forma más extendida. En consecuencia, esperamos que las interacciones intermoleculares para el n-butano sean más fuertes debido a su mayor área de superficie, lo que resulta en un punto de ebullición más alto. El orden general es así como sigue, con puntos de ebullición reales entre paréntesis: propano (−42.1°C) < 2-metilpropano (−11.7°C) < n-butano (−0.5°C) < n-pentano (36.1°C).
Ejercicio
Organizar GeH 4, SiCl 4, SiH 4, CH 4 y GeCl 4 en orden de puntos de ebullición decrecientes.
- Contestar
-
GeCl 4 (87°C) > SiCl 4 (57,6°C) > GeH 4 (−88,5°C) > SiH 4 (−111.8°C) > CH 4 (−161°C)
Enlaces de hidrógeno
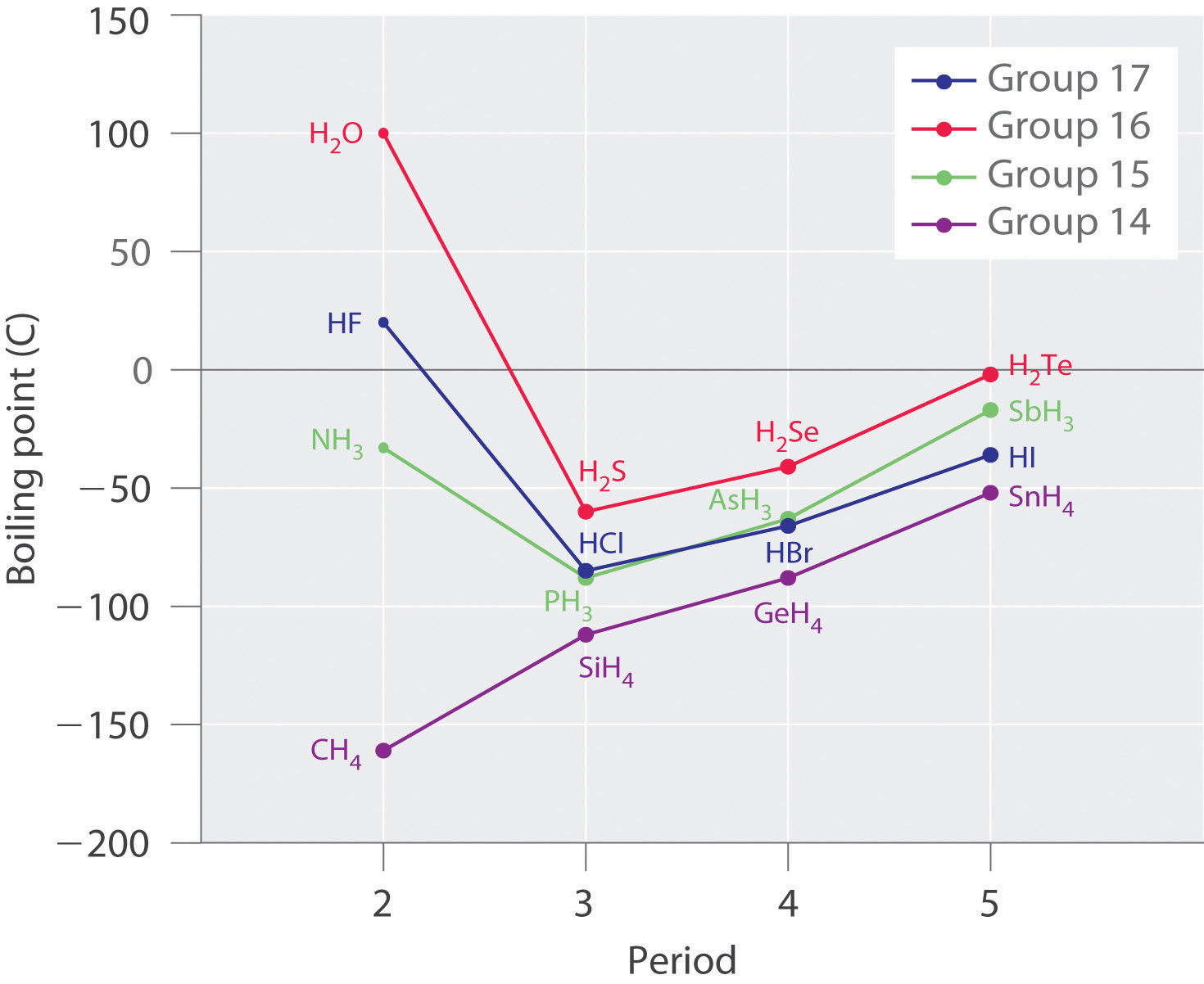
Las moléculas con átomos de hidrógeno unidos a átomos electronegativos como O, N y F (y en mucho menor medida Cl y S) tienden a exhibir interacciones intermoleculares inusualmente fuertes. Estos dan como resultado puntos de ebullición mucho más altos que los observados para las sustancias en las que dominan las fuerzas de dispersión de Londres, como se ilustra para los hidruros covalentes de elementos de los grupos 14—17 en la Figura\(\PageIndex{5}\). El metano y sus congéneres más pesados en el grupo 14 forman una serie cuyos puntos de ebullición aumentan suavemente al aumentar la masa molar. Esta es la tendencia esperada en las moléculas no polares, para las cuales las fuerzas de dispersión de Londres son las fuerzas intermoleculares exclusivas. En contraste, los hidruros de los miembros más ligeros de los grupos 15—17 tienen puntos de ebullición que son más de 100°C mayores de lo previsto en base a sus masas molares. El efecto es más dramático para el agua: si extendemos la línea recta que conecta los puntos para H 2 Te y H 2 Se a la línea para el periodo 2, ¡obtenemos un punto de ebullición estimado de −130°C para el agua! Imagínese las implicaciones para la vida en la Tierra si el agua hierve a -130°C en lugar de 100°C.
¿Por qué fuerzas intermoleculares fuertes producen puntos de ebullición tan anómalos y otras propiedades inusuales, como altas entalpías de vaporización y altos puntos de fusión? La respuesta radica en la naturaleza altamente polar de los enlaces entre el hidrógeno y elementos muy electronegativos como O, N y F. La gran diferencia en la electronegatividad da como resultado una gran carga positiva parcial sobre el hidrógeno y una carga negativa parcial correspondientemente grande en el átomo de O, N o F. En consecuencia, los enlaces H—O, H—N y H-F tienen dipolos de enlace muy grandes que pueden interactuar fuertemente entre sí. Debido a que un átomo de hidrógeno es tan pequeño, estos dipolos también pueden acercarse entre sí más estrechamente que la mayoría de los otros dipolos. La combinación de dipolos de enlace grande y distancias cortas dipolo-dipolo da como resultado interacciones dipolo-dipolo muy fuertes llamadas enlaces de hidrógeno, como se muestra para el hielo en la Figura\(\PageIndex{6}\). Un enlace de hidrógeno generalmente se indica por una línea punteada entre el átomo de hidrógeno unido a O, N o F (el donador de enlaces de hidrógeno) y el átomo que tiene el par solitario de electrones (el aceptor de enlace de hidrógeno). Debido a que cada molécula de agua contiene dos átomos de hidrógeno y dos pares solitarios, una disposición tetraédrica maximiza el número de enlaces de hidrógeno que se pueden formar. En la estructura del hielo, cada átomo de oxígeno está rodeado por un tetraedro distorsionado de átomos de hidrógeno que forman puentes a los átomos de oxígeno de las moléculas de agua adyacentes. Sin embargo, los átomos de hidrógeno puente no son equidistantes de los dos átomos de oxígeno que conectan. En cambio, cada átomo de hidrógeno es 101pm de un oxígeno y 174pm del otro. En contraste, cada átomo de oxígeno está unido a dos átomos de H a la distancia más corta y dos a la distancia más larga, correspondientes a dos enlaces covalentes O—H y dos enlaces de hidrógeno OH de moléculas de agua adyacentes, respectivamente. La resultante estructura abierta, en forma de jaula, del hielo significa que el sólido es en realidad un poco menos denso que el líquido, lo que explica por qué el hielo flota en el agua en lugar de hundirse.
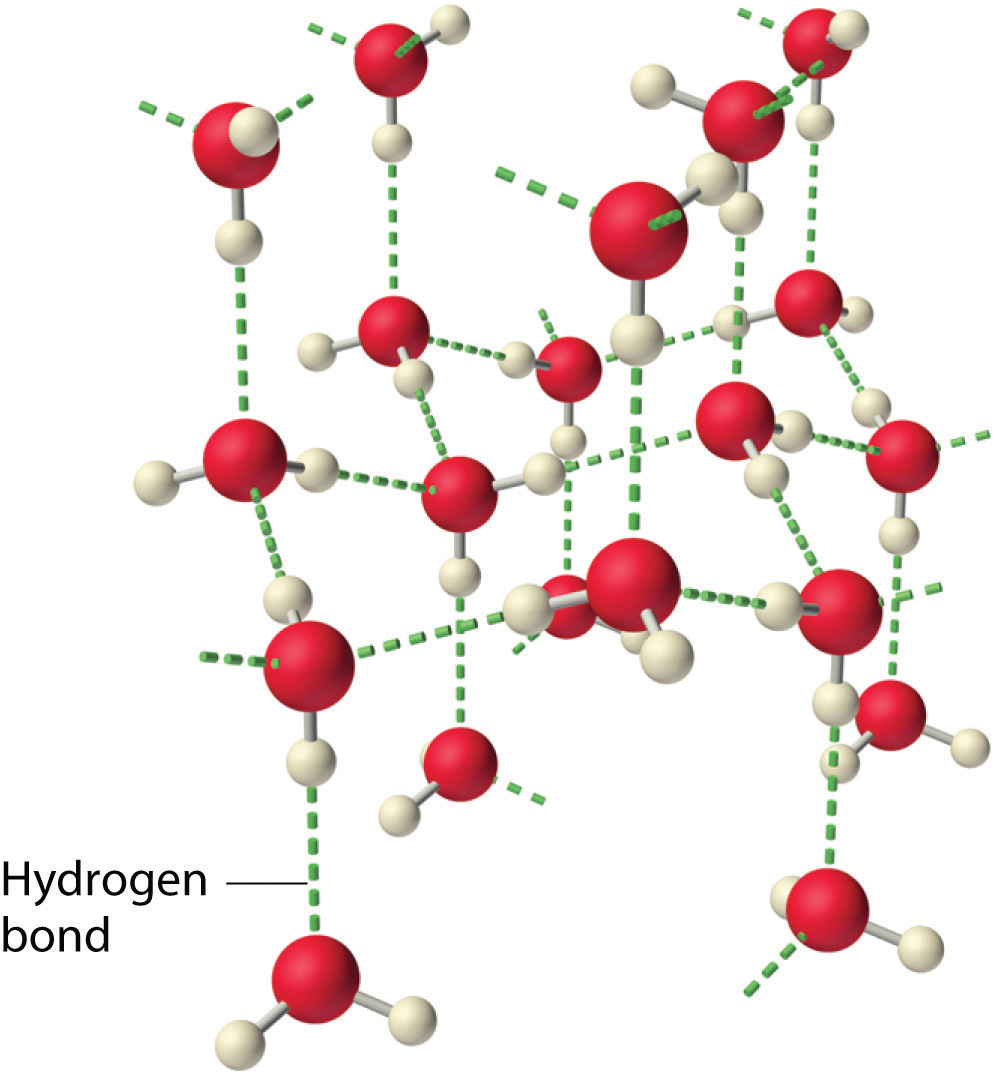
Cada molécula de agua acepta dos enlaces de hidrógeno de otras dos moléculas de agua y dona dos átomos de hidrógeno para formar enlaces de hidrógeno con dos moléculas de agua más, produciendo una estructura abierta en forma de jaula. La estructura del agua líquida es muy similar, pero en el líquido, los enlaces de hidrógeno se rompen continuamente y se forman debido al rápido movimiento molecular.
La formación de enlaces de hidrógeno requiere tanto un donante de enlace de hidrógeno como un aceptor de enlace de hidrógeno.
Debido a que el hielo es menos denso que el agua líquida, los ríos, lagos y océanos se congelan de arriba hacia abajo. De hecho, el hielo forma una capa superficial protectora que aísla el resto del agua, permitiendo que los peces y otros organismos sobrevivan en los niveles inferiores de un lago o mar congelado. Si el hielo fuera más denso que el líquido, el hielo formado en la superficie en clima frío se hundiría tan rápido como se formó. Los cuerpos de agua se congelarían de abajo hacia arriba, lo que sería letal para la mayoría de las criaturas acuáticas. La expansión del agua al congelarse también explica por qué los motores de automóviles o embarcaciones deben estar protegidos por “anticongelante” y por qué las tuberías desprotegidas en las casas se rompen si se les permite congelarse.
Ejemplo
Considerando CH 3 OH, C 2 H 6, Xe, y (CH 3) 3 N, ¿cuáles pueden formar enlaces de hidrógeno consigo mismos? Dibujar las estructuras unidas por hidrógeno.
Dado: compuestos
Preguntado por: formación de enlaces de hidrógeno y estructura
Estrategia:
- Identificar los compuestos con un átomo de hidrógeno unido a O, N o F. Estos probablemente puedan actuar como donantes de enlaces de hidrógeno.
- De los compuestos que pueden actuar como donantes de enlaces de hidrógeno, identificar aquellos que también contienen pares solitarios de electrones, lo que les permite ser aceptores de enlaces de hidrógeno. Si una sustancia es tanto un donador de hidrógeno como un aceptor de enlaces de hidrógeno, dibuje una estructura que muestre el enlace de hidrógeno.
Solución:
A De las especies enumeradas, el xenón (Xe), el etano (C 2 H 6) y la trimetilamina [(CH 3) 3 N] no contienen un átomo de hidrógeno unido a O, N o F; de ahí que no puedan actuar como donantes de enlaces de hidrógeno.
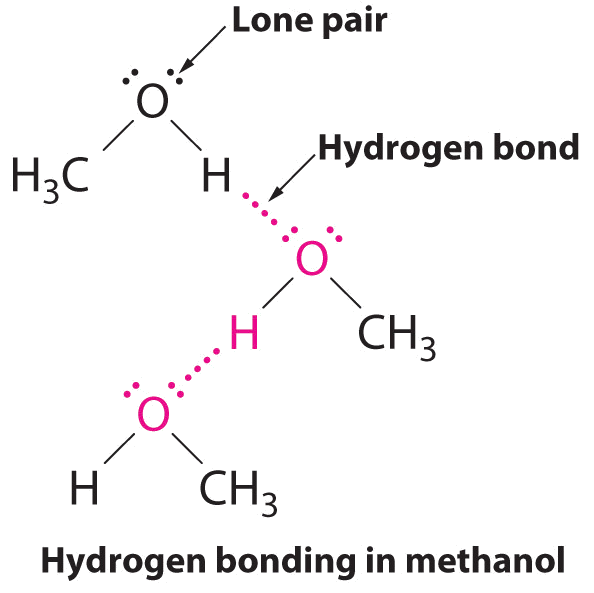
B El único compuesto que puede actuar como donador de enlaces de hidrógeno, metanol (CH 3 OH), contiene tanto un átomo de hidrógeno unido a O (convirtiéndolo en un donador de enlaces de hidrógeno) como dos pares solitarios de electrones en O (convirtiéndolo en un aceptor de enlaces de hidrógeno); el metanol puede así formar enlaces de hidrógeno actuando como un donador de enlaces de hidrógeno o un aceptor de enlaces de hidrógeno. La estructura unida a hidrógeno del metanol es la siguiente:
Ejercicio
Considerando CH 3 CO 2 H, (CH 3) 3 N, NH 3 y CH 3 F, ¿cuáles pueden formar enlaces de hidrógeno consigo mismos? Dibujar las estructuras unidas por hidrógeno.
- Contestar
-
CH 3 CO 2 H y NH 3;
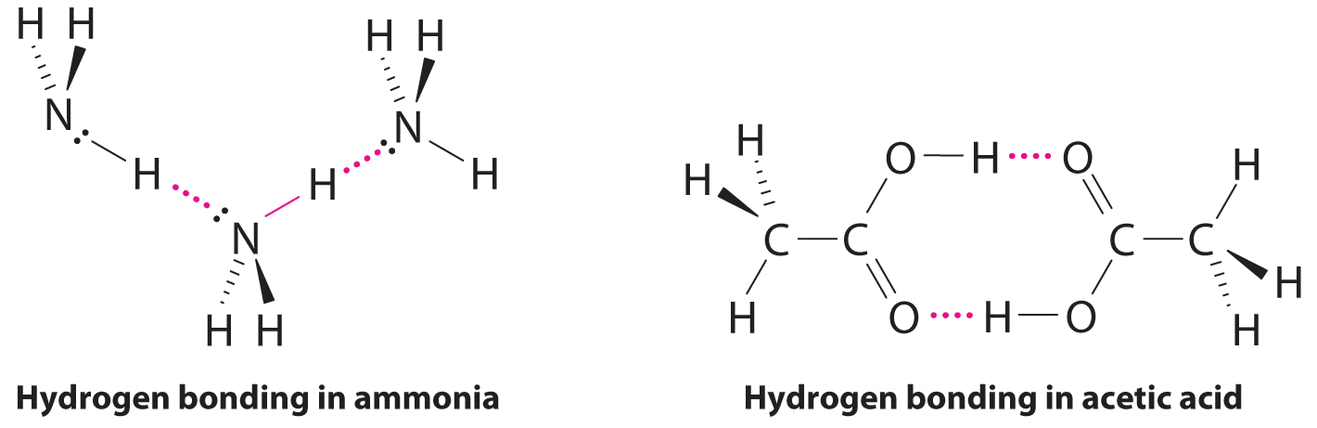
Aunque los enlaces de hidrógeno son significativamente más débiles que los enlaces covalentes, con energías de disociación típicas de solo 15—25 kJ/mol, tienen una influencia significativa en las propiedades físicas de un compuesto. Compuestos como el HF pueden formar solo dos enlaces de hidrógeno a la vez como pueden, en promedio, el NH 3 líquido puro. En consecuencia, aunque sus masas moleculares son similares a las del agua, sus puntos de ebullición son significativamente más bajos que el punto de ebullición del agua, que forma cuatro enlaces de hidrógeno a la vez.
Ejemplo: Buckyballs
Organizar C 60 (buckminsterfullereno, que tiene una estructura de jaula), NaCl, He, Ar y N 2 O en orden de aumentar los puntos de ebullición.
Dado: compuestos
Preguntado por: orden de aumentar los puntos de ebullición
Estrategia:
Identificar las fuerzas intermoleculares en cada compuesto y luego organizar los compuestos de acuerdo con la fuerza de esas fuerzas. La sustancia con las fuerzas más débiles tendrá el punto de ebullición más bajo.
Solución:
Las interacciones electrostáticas son más fuertes para un compuesto iónico, por lo que esperamos que el NaCl tenga el punto de ebullición más alto. Para predecir los puntos de ebullición relativos de los otros compuestos, debemos considerar su polaridad (para las interacciones dipolo-dipolo), su capacidad para formar enlaces de hidrógeno y su masa molar (para las fuerzas de dispersión de Londres). El helio es no polar y con mucho el más ligero, por lo que debe tener el punto de ebullición más bajo. Argón y N 2 O tienen masas molares muy similares (40 y 44 g/mol, respectivamente), pero N 2 O es polar mientras que Ar no lo es. En consecuencia, N 2 O debe tener un punto de ebullición más alto. Una molécula C 60 es no polar, pero su masa molar es de 720 g/mol, mucho mayor que la de Ar o N 2 O. Debido a que los puntos de ebullición de las sustancias no polares aumentan rápidamente con la masa molecular, C 60 debe hervir a una temperatura más alta que las otras sustancias no iónicas. El orden previsto es así como sigue, con puntos de ebullición reales entre paréntesis:
He (−269°C) < Ar (−185.7°C) < N 2 O (−88.5°C) < C 60 (>280°C) < NaCl (1465°C).
Ejercicio
Disponer 2,4-dimetilheptano, Ne, CS 2, Cl 2 y KBr en orden de puntos de ebullición decrecientes.
- Contestar
-
KBr (1435°C) > 2,4-dimetilheptano (132.9°C) > CS 2 (46.6°C) > Cl 2 (−34.6°C) > Ne (−246°C)
Ejemplo
Identificar la fuerza intermolecular más significativa en cada sustancia.
- C 3 H 8
- CH 3 OH
- H 2 S
Solución
a. Aunque los enlaces C—H son polares, solo son mínimamente polares. La fuerza intermolecular más significativa para esta sustancia serían las fuerzas de dispersión.
b. Esta molécula tiene un átomo de H unido a un átomo de O, por lo que experimentará enlaces de hidrógeno.
c. Aunque esta molécula no experimenta enlaces de hidrógeno, el diagrama de puntos electrónicos de Lewis y VSEPR indican que está doblada, por lo que tiene un dipolo permanente. La fuerza más significativa en esta sustancia es la interacción dipolo-dipolo.
Ejercicio
Identificar la fuerza intermolecular más significativa en cada sustancia.
- HF
- HCl
- Contestar a
-
enlaces de hidrógeno
- Respuesta b
-
interacciones dipolo-dipolo
Ejemplos más complejos de enlaces de hidrógeno
La hidratación de iones negativos
Cuando una sustancia iónica se disuelve en agua, las moléculas de agua se agrupan alrededor de los iones separados. Este proceso se llama hidratación. El agua se une frecuentemente a iones positivos mediante enlaces coordinados (covalentes dativos). Se une a iones negativos usando enlaces de hidrógeno.
Si estás interesado en la unión en iones positivos hidratados, podrías seguir este enlace para coordinarse (dativo covalente) enlace.
El diagrama muestra los potenciales enlaces de hidrógeno formados a un ion cloruro, Cl-. Si bien los pares solitarios en el ion cloruro están en el nivel 3 y normalmente no serían lo suficientemente activos para formar enlaces de hidrógeno, en este caso se hacen más atractivos por la carga negativa total sobre el cloro.
Por complicado que sea el ion negativo, siempre habrá pares solitarios a los que los átomos de hidrógeno de las moléculas de agua puedan enlazarse con hidrógeno.
Enlace de hidrógeno en alcoholes
Un alcohol es una molécula orgánica que contiene un grupo -OH. Cualquier molécula que tenga un átomo de hidrógeno unido directamente a un oxígeno o un nitrógeno es capaz de formar enlaces de hidrógeno. Tales moléculas siempre tendrán puntos de ebullición más altos que las moléculas de tamaño similar que no tienen un grupo -O-H o un grupo -N-H. El enlace de hidrógeno hace que las moléculas sean “más adherentes”, y se necesita más calor para separarlas.
Etanol, CH 3 CH 2 OH, y metoximetano, CH 3 OCH 3, son isómeros estructurales con la misma fórmula molecular, C 2 H 6 O.
Tienen el mismo número de electrones, y una longitud similar a la molécula. Las atracciones de van der Waals (tanto las fuerzas de dispersión como las atracciones dipolo-dipolo) en cada una serán muy iguales. Sin embargo, el etanol tiene un átomo de hidrógeno unido directamente a un oxígeno, y ese oxígeno todavía tiene exactamente los mismos dos pares solitarios que en una molécula de agua. Los enlaces de hidrógeno pueden ocurrir entre las moléculas de etanol, aunque no tan eficazmente como en el agua. El enlace de hidrógeno está limitado por el hecho de que solo hay un hidrógeno en cada molécula de etanol con suficiente carga +.
En metoximetano, los pares solitarios en el oxígeno siguen ahí, pero los hidrógenos no lo están suficientemente + para que se formen enlaces de hidrógeno. Excepto en algunos casos bastante inusuales, el átomo de hidrógeno tiene que estar unido directamente al elemento muy electronegativo para que se produzca el enlace de hidrógeno. Los puntos de ebullición del etanol y el metoximetano muestran el dramático efecto que el enlace de hidrógeno tiene sobre la adherencia de las moléculas de etanol:
| etanol (con enlaces de hidrógeno) | 78.5°C |
| metoximetano (sin enlaces de hidrógeno) | -24.8°C |
El enlace de hidrógeno en el etanol ha elevado su punto de ebullición alrededor de 100°C Es importante darse cuenta de que existe enlace de hidrógeno además de las atracciones de van der Waals. Por ejemplo, todas las siguientes moléculas contienen el mismo número de electrones, y las dos primeras tienen mucho la misma longitud. El mayor punto de ebullición del butan-1-ol se debe al enlace de hidrógeno adicional.
Al comparar los dos alcoholes (que contienen grupos -OH), ambos puntos de ebullición son altos debido al enlace de hidrógeno adicional debido al hidrógeno unido directamente al oxígeno, pero no son los mismos. El punto de ebullición del 2-metilpropan-1-ol no es tan alto como el butan-1-ol porque la ramificación en la molécula hace que las atracciones de van der Waals sean menos efectivas que en el butan-1-ol más largo.
Enlace de hidrógeno en moléculas orgánicas que contienen nitrógeno
Los enlaces de hidrógeno también ocurren en moléculas orgánicas que contienen grupos N-H, de la misma manera que ocurre en el amoníaco. Los ejemplos van desde moléculas simples como CH 3 NH 2 (metilamina ) hasta moléculas grandes como proteínas y ADN. Las dos cadenas de la famosa doble hélice en el ADN se mantienen unidas por enlaces de hidrógeno entre átomos de hidrógeno unidos al nitrógeno en una hebra, y pares solitarios en otra nitrógeno o un oxígeno en la otra.
Donantes y aceptadores
Para que ocurra un enlace de hidrógeno debe haber tanto un donante de hidrógeno como un aceptor presentes. El donante en un enlace de hidrógeno es el átomo al que el átomo de hidrógeno que participa en el enlace de hidrógeno está unido covalentemente, y suele ser un átomo fuertemente electronegativo como N, O o F. El aceptor de hidrógeno es el ion electronegativo vecino o molécula, y debe poseer un par de electrones solitarios para formar un enlace de hidrógeno.
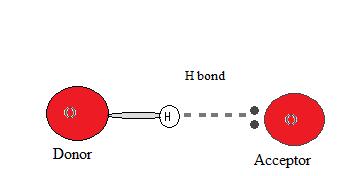
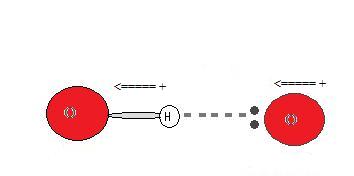
¿Por qué ocurre un enlace de hidrógeno?
Dado que el donante de hidrógeno es fuertemente electronegativo, atrae al par de electrones unido covalentemente más cerca de su núcleo, y lejos del átomo de hidrógeno. El átomo de hidrógeno se deja entonces con una carga positiva parcial, creando una atracción dipolo-dipolo entre el átomo de hidrógeno unido al donante, y el par de electrones solitarios en la acepton. Esto da como resultado un enlace de hidrógeno. (ver Interacciones entre moléculas con dipolos permanentes)
Tipos de enlaces de hidrógeno
Los enlaces de hidrógeno pueden ocurrir dentro de una sola molécula, entre dos moléculas similares o entre dos moléculas diferentes.
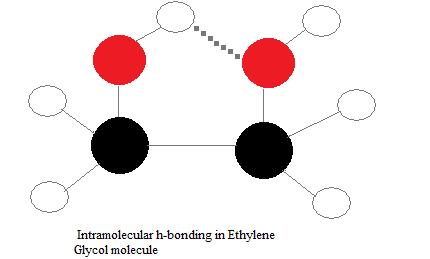
Enlaces de hidrógeno intramoleculares
Los enlaces de hidrógeno intramoleculares son aquellos que ocurren dentro de una sola molécula. Esto ocurre cuando dos grupos funcionales de una molécula pueden formar enlaces de hidrógeno entre sí. Para que esto suceda, tanto un donante de hidrógeno como un aceptor deben estar presentes dentro de una molécula, y deben estar muy cerca uno del otro en la molécula. Por ejemplo, los enlaces de hidrógeno intramoleculares se producen en etilenglicol (C 2 H 4 (OH) 2) entre sus dos grupos hidroxilo debido a la geometría molecular.
Enlaces de hidrógeno intermoleculares
Los enlaces de hidrógeno intermoleculares ocurren entre moléculas separadas en una sustancia. Pueden ocurrir entre cualquier número de moléculas similares o diferentes siempre y cuando los donantes y aceptores de hidrógeno estén presentes y en posiciones en las que puedan interactuar. Por ejemplo, los enlaces de hidrógeno intermoleculares pueden ocurrir entre moléculas NH 3 solas, entre moléculas H 2 O solas, o entre NH 3 y H 2 O moléculas.
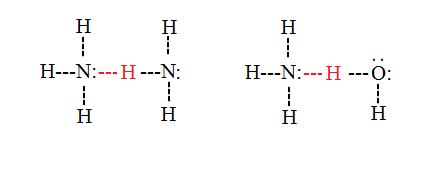
Propiedades y efectos de los enlaces de hidrógeno
En punto de ebullición
Cuando consideramos los puntos de ebullición de las moléculas, generalmente esperamos que las moléculas con masas molares más grandes tengan puntos de ebullición normales más altos que las moléculas con masas molares más pequeñas. Esto, sin tener en cuenta los enlaces de hidrógeno, se debe a mayores fuerzas de dispersión (ver Interacciones entre moléculas no polares). Las moléculas más grandes tienen más espacio para la distribución de electrones y, por lo tanto, más posibilidades para un momento dipolo instantáneo. No obstante, cuando consideramos la siguiente tabla, vemos que no siempre es así.
| Compuesto | Masa molar | Punto de ebullición normal |
|---|---|---|
| \(H_2O\) | 18 g/mol | 373 K |
| \(HF\) | 20 g/mol | 292.5 K |
| \(NH_3\) | 17 g/mol | 239.8 K |
| \(H_2S\) | 34 g/mol | 212.9 K |
| \(HCl\) | 36.4 g/mol | 197.9 K |
| \(PH_3\) | 34 g/mol | 185.2 K |
We see that H2O, HF, and NH3 each have higher boiling points than the same compound formed between hydrogen and the next element moving down its respective group, indicating that the former have greater intermolecular forces. This is because H2O, HF, and NH3 all exhibit hydrogen bonding, whereas the others do not. Furthermore, \(H_2O\) has a smaller molar mass than HF but partakes in more hydrogen bonds per molecule, so its boiling point is consequently higher.
On Viscosity
The same effect that is seen on boiling point as a result of hydrogen bonding can also be observed in the viscosity of certain substances. Those substances which are capable of forming hydrogen bonds tend to have a higher viscosity than those that do not. Substances which have the possibility for multiple hydrogen bonds exhibit even higher viscosities.
Factors preventing Hydrogen bonding
Electronegativity
Hydrogen bonding cannot occur without significant electronegativity differences between hydrogen and the atom it is bonded to. Thus, we see molecules such as PH3, which no not partake in hydrogen bonding. PH3 exhibits a trigonal pyramidal molecular geometry like that of ammmonia, but unlike NH3 it cannot hydrogen bond. This is due to the similarity in the electronegativities of phosphorous and hydrogen. Both atoms have an electronegativity of 2.1, and thus, no dipole moment occurs. This prevents the hydrogen bonding from acquiring the partial positive charge needed to hydrogen bond with the lone electron pair in another molecule. (see Polarizability)
Tamaño del átomo
El tamaño de los donantes y aceptores también puede afectar la capacidad de enlace de hidrógeno. Esto puede explicar la capacidad relativamente baja del Cl para formar enlaces de hidrógeno. Cuando los radios de dos átomos difieren mucho o son grandes, sus núcleos no pueden lograr una estrecha proximidad cuando interactúan, lo que resulta en una interacción débil.
Enlace de hidrógeno en la naturaleza
Los enlaces de hidrógeno juegan un papel crucial en muchos procesos biológicos y pueden dar cuenta de muchos fenómenos naturales como las propiedades inusuales del agua. Además de estar presentes en el agua, los enlaces de hidrógeno también son importantes en el sistema de transporte de agua de las plantas, la estructura proteica secundaria y terciaria, y el emparejamiento de bases de ADN.
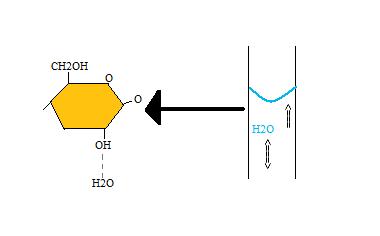
Plantas
La teoría de cohesión-adhesión del transporte en plantas vasculares utiliza enlaces de hidrógeno para explicar muchos componentes clave del movimiento del agua a través del xilema de la planta y otros vasos. Dentro de un recipiente, las moléculas de agua se unen de hidrógeno no solo entre sí, sino también con la cadena de celulosa que comprende la pared de las células vegetales. Esto crea una especie de tubo capilar que permite que se produzca la acción capilar ya que el vaso es relativamente pequeño. Este mecanismo permite a las plantas extraer agua hacia sus raíces. Además, los enlaces de hidrógeno pueden crear una larga cadena de moléculas de agua que pueden superar la fuerza de la gravedad y viajar hasta las altas altitudes de las hojas.
Proteínas
Los enlaces de hidrógeno están presentes abundantemente en la estructura secundaria de las proteínas, y también escasamente en la conformación terciaria. La estructura secundaria de una proteína implica interacciones (principalmente enlaces de hidrógeno) entre cadenas principales polipeptídicas vecinas que contienen pares unidos Nitrógeno-Hidrógeno y átomos de oxígeno. Dado que tanto el N como el O son fuertemente electronegativos, los átomos de hidrógeno unidos al nitrógeno en una cadena principal polipeptídica pueden unirse por hidrógeno a los átomos de oxígeno en otra cadena y viceversa. Aunque son relativamente débiles, estos enlaces ofrecen una gran estabilidad a la estructura proteica secundaria porque se repiten una gran cantidad de veces.
En la estructura de proteína terciaria, las interacciones son principalmente entre grupos R funcionales de una cadena polipeptídica; una de esas interacciones se llama interacción hidrófoba. Estas interacciones ocurren debido a los enlaces de hidrógeno entre las moléculas de agua alrededor del hidrófobo y refuerzan aún más la conformación.
Referencias
- Chang, Raymond. Química General:Los Conceptos Esenciales. 3ª ed. Nueva York: Mcgraw Hill, 2003
- Petrucci, et al. Química General: Principios y Aplicaciones Modernas. 9ª ed. Upper Saddle River, Nueva Jersey: Pearson/Prentice Hall, 2007.
Colaboradores
- José Pietri

