2.12: Fuerzas y Solubilidades Intermoleculares
- Page ID
- 76694
Objetivo de aprendizaje
- predecir si una mezcla de compuestos formará una solución homogénea o heterogénea
El tipo de fuerzas intermoleculares (IMF) exhibidas por los compuestos se puede utilizar para predecir si se pueden mezclar dos compuestos diferentes para formar una solución homogénea (soluble o miscible). Porque la química orgánica puede realizar reacciones en soluciones no acuosas usando solventes orgánicos. Es importante considerar el disolvente como un parámetro de reacción y la solubilidad de cada reactivo. Dicho esto, los efectos solventes son secundarios a los esteros y electrostáticos de los reactivos. Asegúrate de no ahogarte en el solvente.
Solubilidad
Prácticamente toda la química orgánica que verás en este curso se lleva a cabo en fase de solución. En el laboratorio orgánico, las reacciones a menudo se realizan en disolventes no polares o ligeramente polares como tolueno (metilbenceno), hexano, diclorometano o éter dietilico. En los últimos años, se ha hecho mucho esfuerzo para adaptar las condiciones de reacción para permitir el uso de solventes 'más ecológicos' (es decir, más amigables con el medio ambiente) como el agua o el etanol, que son polares y capaces de formar enlaces de hidrógeno. En las reacciones orgánicas que ocurren en la región citosólica de una célula, el disolvente es, por supuesto, agua. Es fundamental que cualquier químico orgánico comprenda los factores que intervienen en la solubilidad de diferentes moléculas en diferentes solventes.
Probablemente recuerdes la regla que aprendiste en química general respecto a la solubilidad: 'como se disuelve como' (e incluso antes de tomar alguna química en absoluto, probablemente observaste en algún momento de tu vida que el aceite no se mezcla con el agua). Repasemos esta vieja regla, y pongamos a trabajar nuestro conocimiento de la unión covalente y no covalente.
Imagina que tienes un matraz lleno de agua, y una selección de sustancias que probarás para ver qué tan bien se disuelven en el agua. La primera sustancia es la sal de mesa, o cloruro de sodio. Como seguramente predeciría, especialmente si alguna vez ha tomado inadvertidamente un bocado de agua mientras nada en el océano, este compuesto iónico se disuelve fácilmente en el agua. ¿Por qué? Debido a que el agua, como molécula muy polar, es capaz de formar muchas interacciones ión-dipolo tanto con el catión sodio como con el anión cloruro, cuya energía es más que suficiente para compensar la energía requerida para romper las interacciones ión-ion en el cristal de sal y algunos enlaces de hidrógeno agua-agua.

El resultado final, entonces, es que en lugar de cristales de cloruro de sodio, tenemos cationes de sodio individuales y aniones cloruro rodeados de moléculas de agua, la sal ahora está en solución. Las especies cargadas por regla general se disuelven fácilmente en el agua: en otras palabras, son muy hidrófilas (amantes del agua).
Ahora, probaremos un compuesto llamado bifenilo, que, al igual que el cloruro de sodio, es una sustancia cristalina incolora (los dos compuestos son fácilmente distinguibles a la vista, sin embargo, los cristales se ven bastante diferentes).
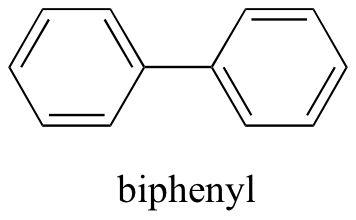
El bifenilo no se disuelve en absoluto en agua. ¿Por qué es esto? Porque es una molécula muy no polar, con solo enlaces carbono-carbono y carbono-hidrógeno. Es capaz de unirse a sí mismo muy bien a través de interacciones no polares (dispersión de Londres), pero no es capaz de formar interacciones atractivas significativas con las moléculas de disolvente muy polares. Así, el costo energético de romper las interacciones bifenilo-bifenilo en el sólido es alto, y se gana muy poco en términos de nuevas interacciones bifenil-agua. El agua es un terrible disolvente para las moléculas de hidrocarburos no polares: son muy hidrofóbicas ('temerosas del agua').
A continuación, prueba una serie de compuestos alcohólicos cada vez más grandes, comenzando con metanol (1 carbono) y terminando con octanol (8 carbonos).
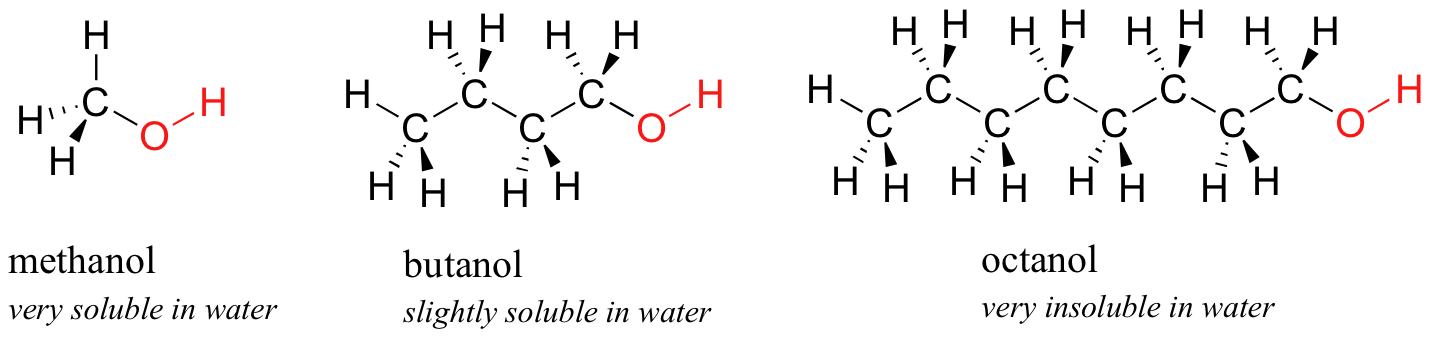
Encuentras que los alcoholes más pequeños -metanol, etanol y propanol- se disuelven fácilmente en agua. Esto se debe a que el agua es capaz de formar enlaces de hidrógeno con el grupo hidroxilo en estas moléculas, y la energía combinada de formación de estos enlaces de hidrógeno agua-alcohol es más que suficiente para compensar la energía que se pierde cuando se rompen los enlaces de hidrógeno alcohol-alcohol. Cuando intentas butanol, sin embargo, comienzas a notar que, a medida que agregas más y más al agua, comienza a formar su propia capa encima del agua.
Los alcoholes de cadena más larga -pentanol, hexanol, heptanol y octanol- son cada vez más insolubles. ¿Qué está pasando aquí? Claramente, los mismos enlaces de hidrógeno agua-alcohol favorables aún son posibles con estos alcoholes más grandes. La diferencia, por supuesto, es que los alcoholes más grandes tienen regiones hidrofóbicas no polares más grandes además de su grupo hidroxilo hidrófilo. A aproximadamente cuatro o cinco carbonos, el efecto hidrofóbico comienza a superar el efecto hidrófilo y se pierde la solubilidad en agua.
Ahora, intente disolver la glucosa en el agua —aunque tenga seis carbonos al igual que el hexanol, también tiene cinco grupos hidroxilo hidrófilos con enlaces de hidrógeno además de un sexto oxígeno que es capaz de ser un aceptor de enlaces de hidrógeno.
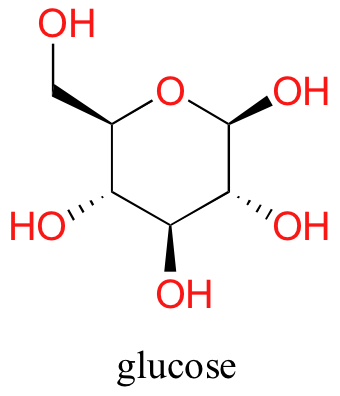
Hemos volcado las escamas hacia el lado hidrófilo, y encontramos que la glucosa es bastante soluble en agua.
Vimos que el etanol era muy soluble en agua (si no lo fuera, ¡beber cerveza o vodka sería bastante inconveniente!) ¿Qué tal el éter dimetílico, que es un isómero constitucional del etanol pero con un éter en lugar de un grupo funcional alcohol? Encontramos que el éter dietílico es mucho menos soluble en agua. ¿Es capaz de formar enlaces de hidrógeno con el agua? Sí, de hecho, lo es —el oxígeno éter puede actuar como aceptor de enlaces de hidrógeno. La diferencia entre el grupo éter y el grupo alcohol, sin embargo, es que el grupo alcohol es tanto un donador como un aceptor de enlaces de hidrógeno.
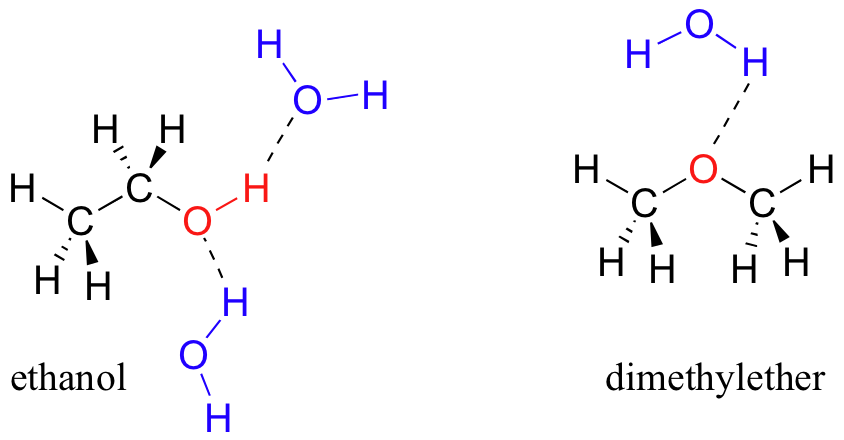
El resultado es que el alcohol es capaz de formar interacciones más energéticamente favorables con el disolvente en comparación con el éter, por lo que el alcohol es más soluble.
Aquí hay otro experimento fácil que se puede hacer (con la supervisión adecuada) en un laboratorio orgánico. Intenta disolver los cristales de ácido benzoico en agua a temperatura ambiente; encontrarás que no es soluble. Como aprenderemos cuando estudiemos la química ácido-base en un capítulo posterior, los ácidos carboxílicos como el ácido benzoico son ácidos relativamente débiles, y por lo tanto existen principalmente en forma ácida (protonada) cuando se agregan al agua pura.
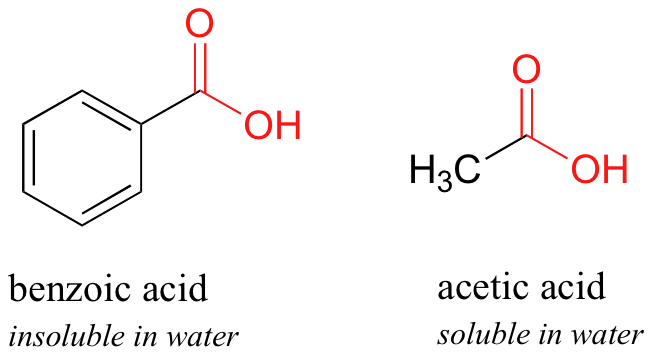
El ácido acético, sin embargo, es bastante soluble. Esto es fácil de explicar usando el argumento alcohol pequeño vs alcohol grande: el efecto hidrofílico de enlace de hidrógeno del grupo ácido carboxílico es lo suficientemente poderoso como para superar el efecto hidrófobo de un solo grupo metilo sobre el ácido acético, pero no el mayor efecto hidrofóbico del grupo benceno de 6 carbonos en ácido benzoico.
Ahora, intente agregar lentamente un poco de hidróxido de sodio acuoso al matraz que contiene ácido benzoico no disuelto. A medida que el disolvente se vuelve cada vez más básico, el ácido benzoico comienza a disolverse, hasta que está completamente en solución.
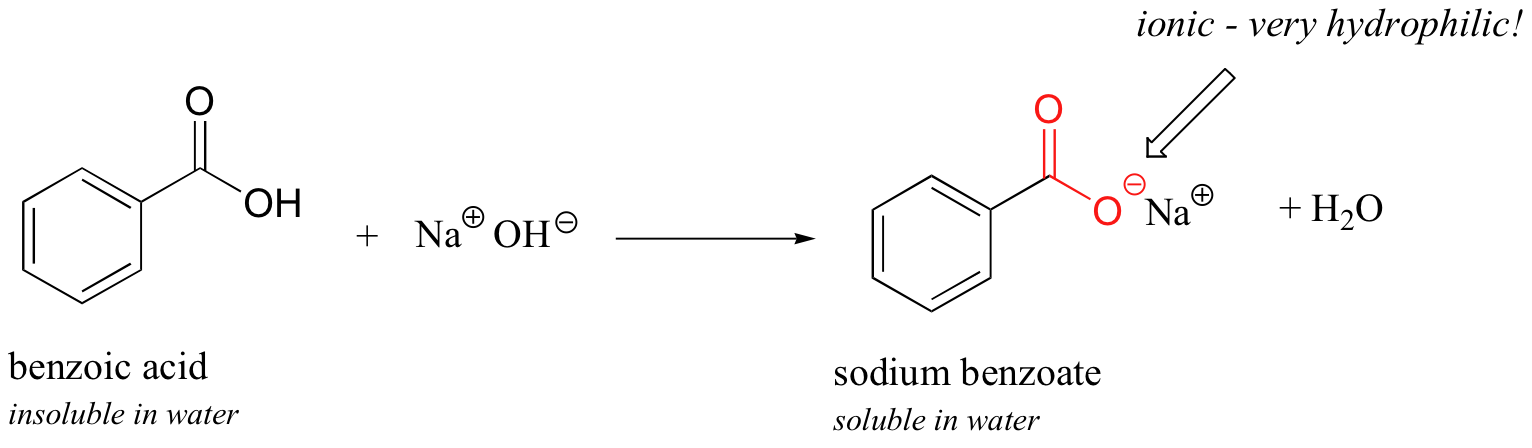
Lo que está sucediendo aquí es que el ácido benzoico se está convirtiendo en su base conjugada, el benzoato. El grupo ácido carboxílico neutro no era lo suficientemente hidrófilo como para constituir el anillo de benceno hidrófobo, pero el grupo carboxilato, con su carga negativa completa, es mucho más hidrófilo. Ahora, la balanza se inclina a favor de la solubilidad en agua, ya que la parte aniónica poderosamente hidrofílica de la molécula arrastra la parte hidrófoba, pateando y gritando, (si un anillo de benceno puede patear y gritar) en solución. Si quieres precipitar el ácido benzoico de nuevo de la solución, simplemente puedes agregar suficiente ácido clorhídrico para neutralizar la solución y reprotonar el carboxilato.
Si estás tomando un componente de laboratorio de tu curso de química orgánica, probablemente harás al menos un experimento en el que usarás este fenómeno para separar un ácido orgánico como el ácido benzoico de un compuesto hidrocarbonado como el bifenilo.
Se pueden hacer argumentos similares para racionalizar la solubilidad de diferentes compuestos orgánicos en disolventes no polares o ligeramente polares. En general, cuanto mayor es el contenido de grupos cargados y polares en una molécula, menos soluble tiende a ser en disolventes como el hexano. El cloruro de sodio iónico y muy hidrófilo, por ejemplo, no es en absoluto soluble en disolvente hexano, mientras que el bifenilo hidrófobo es muy soluble en hexano.
Ejercicio
1. Las vitaminas pueden clasificarse como solubles en agua o liposolubles (considere que la grasa es un 'disolvente' muy no polar e hidrofóbico. Decidir una clasificación para cada una de las vitaminas que se muestran a continuación.
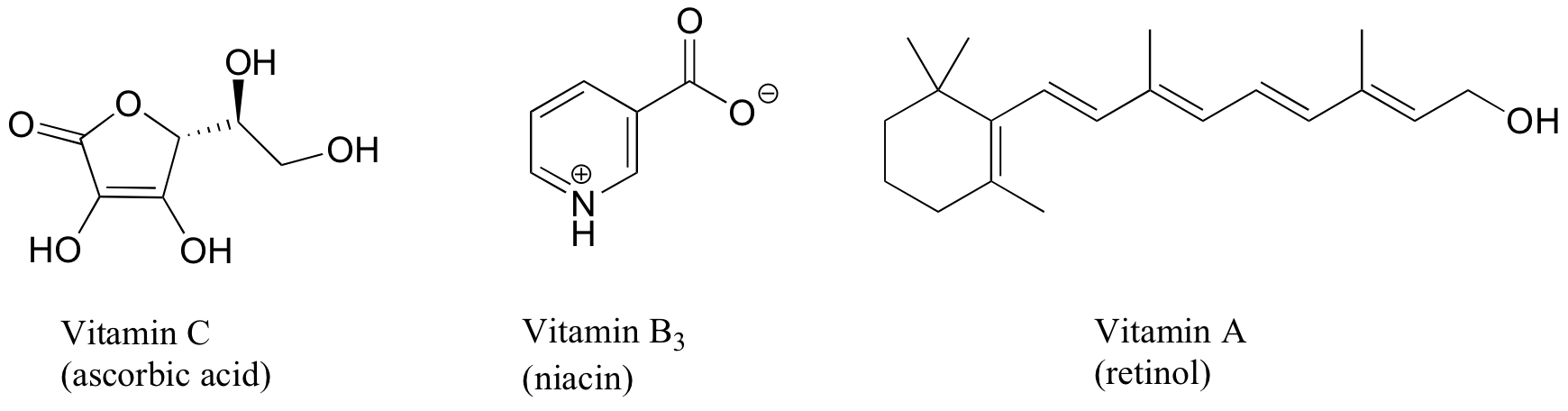
Ejercicio
2. Tanto la anilina como el fenol son insolubles en agua pura. Predice la solubilidad de estos dos compuestos en ácido clorhídrico acuoso al 10%, y explica tu razonamiento. Pista — en este contexto, la anilina es básica, ¡el fenol no lo es!
Ilustraciones de conceptos de solubilidad: intermedios metabólicos, membranas bicapa lipídicas, jabones y detergentes
Debido a que el agua es el disolvente biológico, la mayoría de las moléculas orgánicas biológicas, para mantener la solubilidad en agua, contienen uno o más grupos funcionales cargados. Estos suelen ser fosfato, amonio o carboxilato, todos los cuales se cargan cuando se disuelven en una solución acuosa tamponada a pH 7.
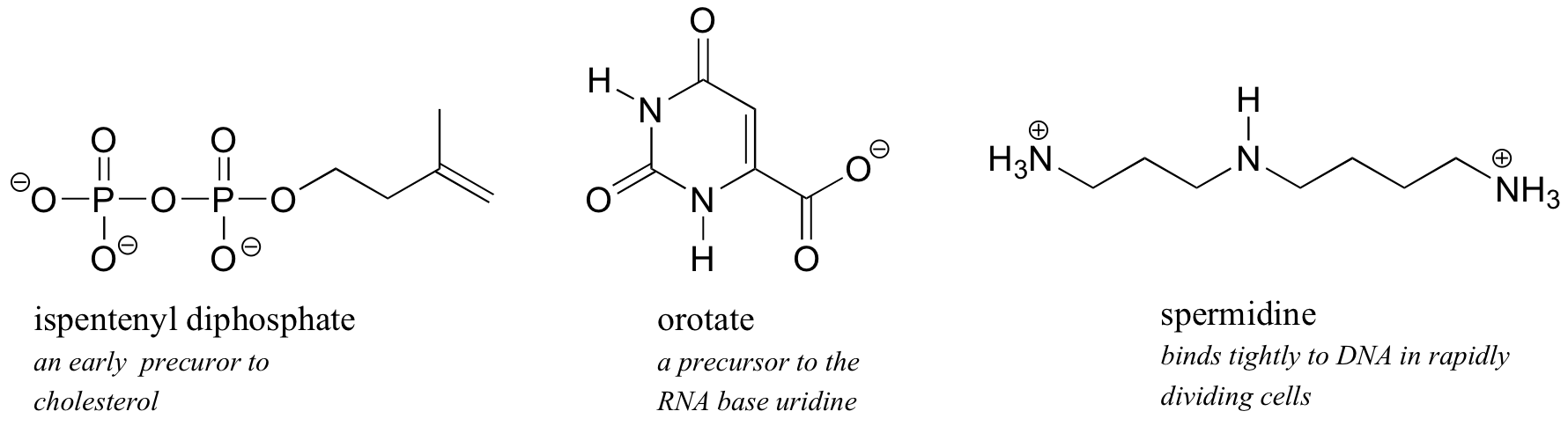
Los azúcares a menudo carecen de grupos cargados, pero como discutimos en nuestro 'experimento de pensamiento' con glucosa, son bastante solubles en agua debido a la presencia de múltiples grupos hidroxilo.
Algunas biomoléculas, por el contrario, contienen componentes hidrófobos claramente no polares. Las membranas de 'bicapa lipídica' de células y orgánulos subcelulares sirven para encerrar volúmenes de agua y miríadas de biomoléculas en solución. Las moléculas lipídicas (grasas) que componen las membranas son anfipáticas: tienen una 'cabeza' cargada e hidrofílica y una 'cola' hidrofóbica de hidrocarburo.
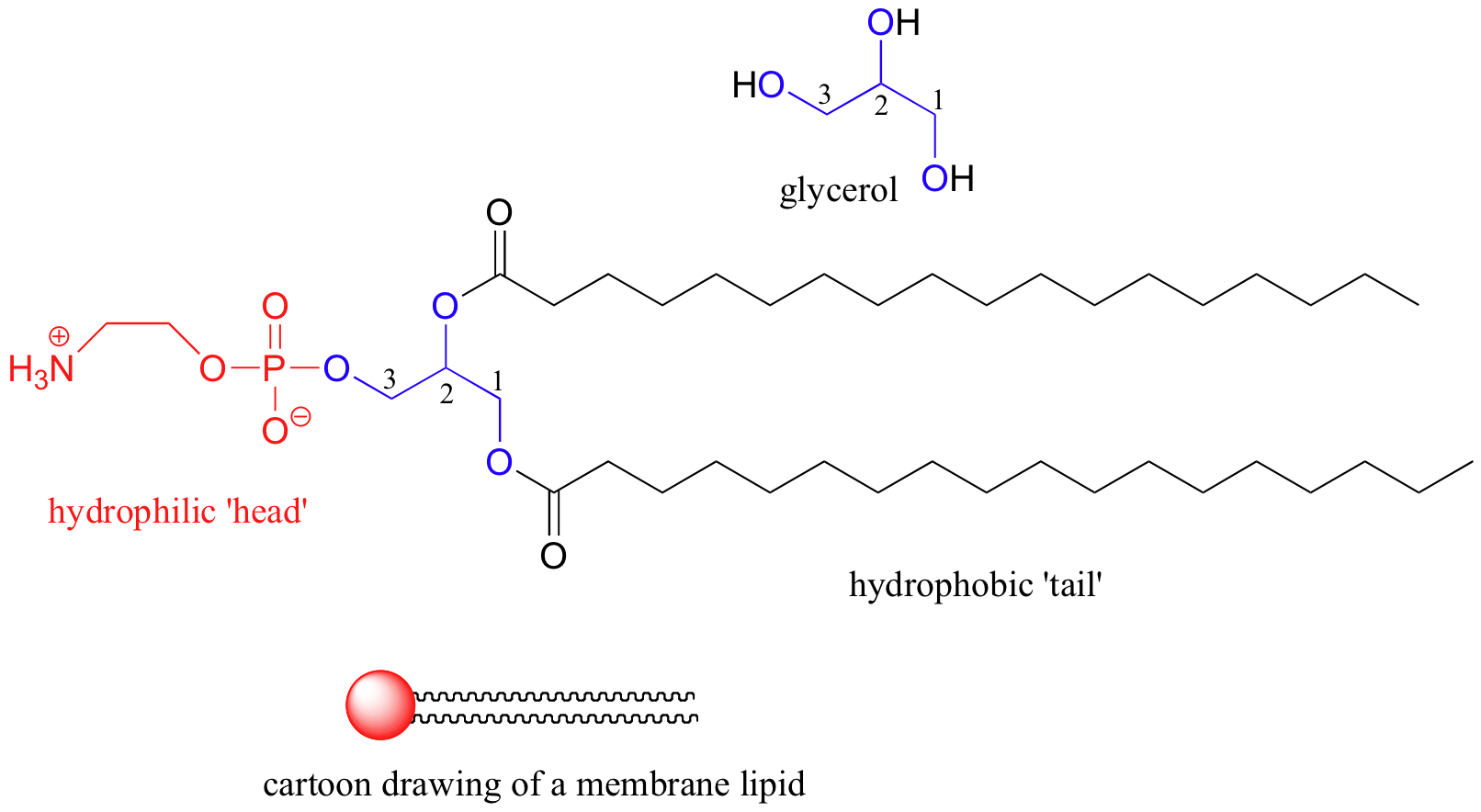
Imagen 3D interactiva de un fosfolípido de membrana (BioTopics)
Observe que toda la molécula está construida sobre una 'cadena principal' de glicerol, una molécula simple de 3 carbonos con tres grupos alcohol. En una estructura de membrana biológica, las moléculas lipídicas están dispuestas en una bicapa esférica: las colas hidrófobas apuntan hacia adentro y se unen por las fuerzas de dispersión de Londres, mientras que los grupos de cabeza hidrófilos forman las superficies interna y externa en contacto con el agua.
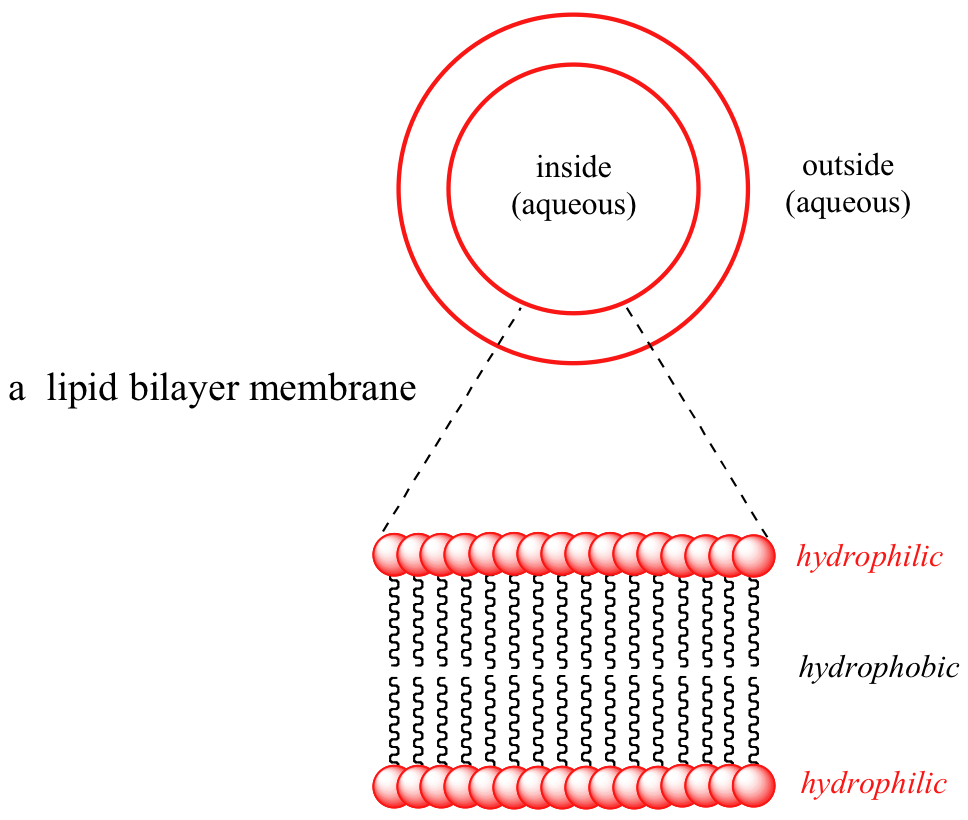
Imagen 3D interactiva de una bicapa lipídica (BioTopics)
Debido a que el interior de la bicapa es extremadamente hidrofóbico, las biomoléculas (que como sabemos son generalmente especies cargadas) no son capaces de difundirse a través de la membrana, simplemente no son solubles en el interior hidrófobo. Por lo tanto, el transporte de moléculas a través de la membrana de una célula u orgánelo se puede lograr de manera controlada y específica mediante proteínas especiales de transporte transmembrana, un tema fascinante del que aprenderás más si tomas una clase de bioquímica.
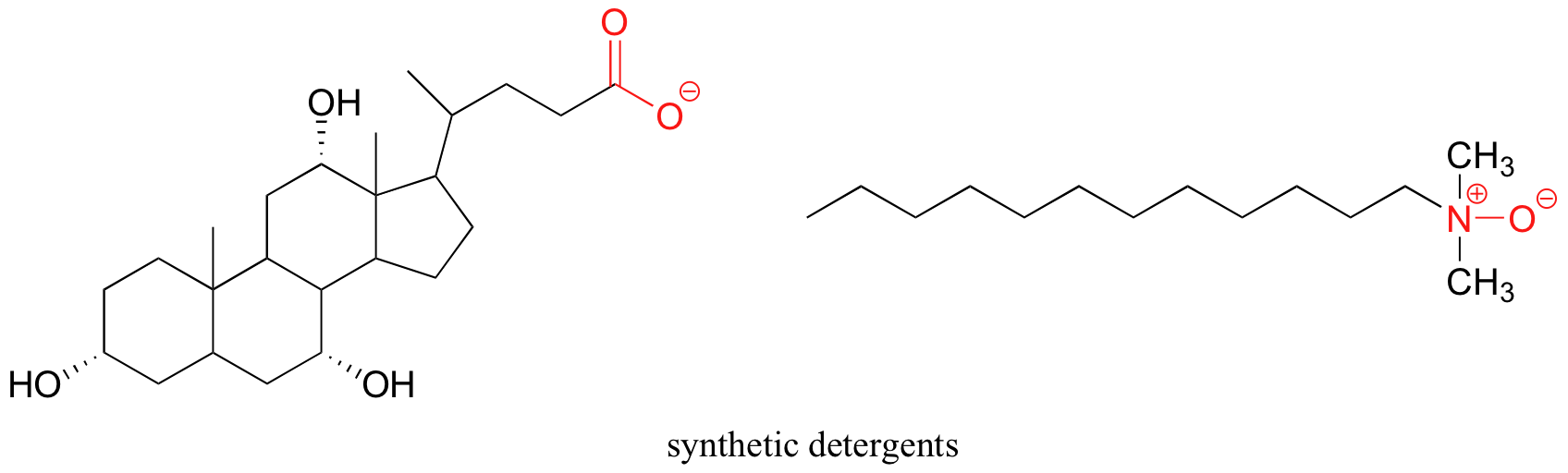
Un principio similar es la base para la acción de los jabones y detergentes. Los jabones están compuestos de ácidos grasos, que son cadenas hidrocarbonadas hidrófobas largas (típicamente de 18 carbonos) con un grupo carboxilato (cargado) en un extremo,
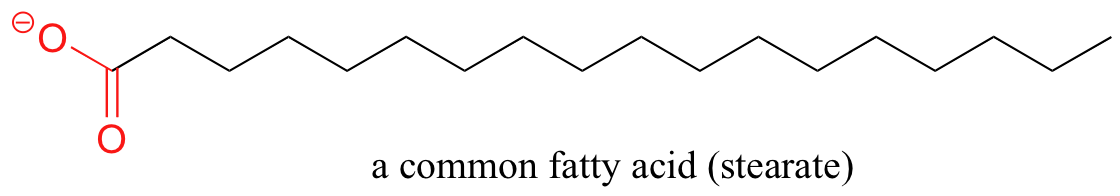
Los ácidos grasos se derivan de grasas y aceites animales y vegetales. En solución acuosa, las moléculas de ácidos grasos en los jabones formarán espontáneamente micelas, una estructura esférica que permite que las colas hidrófobas eviten el contacto con el agua y simultáneamente formen contactos favorables de dispersión en Londres.
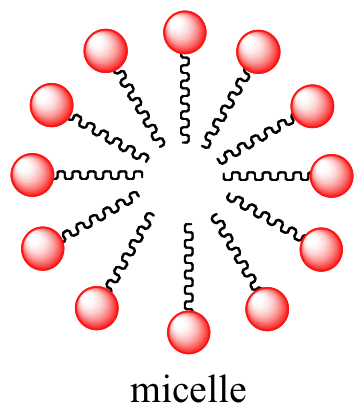
Imágenes 3D interactivas de una molécula de jabón de ácidos grasos y una micela de jabón (Edutopics)
Debido a que el exterior de la micela está cargado e hidrofílico, la estructura en su conjunto es soluble en agua. Las micelas se formarán espontáneamente alrededor de pequeñas partículas de aceite que normalmente no se disolverían en agua (como esa mancha grasosa en tu camisa de la rodaja de pepperoni que se cayó de tu pizza), y llevarán la partícula con ella a la solución. Aprenderemos más sobre la química de la elaboración de jabón en un capítulo posterior (sección 12.4B).
Los detergentes sintéticos son moléculas anfipáticas no naturales que funcionan según el mismo principio que el descrito para los jabones.