2.14: Grupos Funcionales Orgánicos - Donantes de enlaces H y aceptores de enlaces H
- Page ID
- 76666
Objetivo de aprendizaje
- distinguir entre compuestos orgánicos que son donantes de enlaces H versus aceptores de enlaces H
Donantes de enlaces H vs aceptores de enlaces H
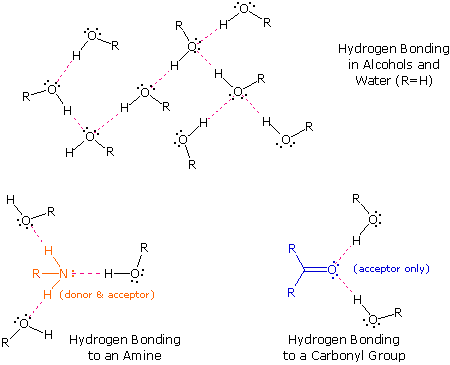
Los compuestos con enlace H como su fuerza intermolecular dominante (IMF) son AMBOS donantes de enlaces H y aceptores de enlaces H. Son donantes de enlaces H porque tienen un átomo de hidrógeno altamente polar unido a un átomo fuertemente electronegativo, principalmente nitrógeno, oxígeno o flúor (NOF). Debido a que hay una carga negativa parcial equivalente en el átomo unido al hidrógeno (principalmente NOF), este átomo puede aceptar enlaces H de otros átomos. Dado que los donantes de enlaces H SIEMPRE son aceptores de enlaces H, simplificamos la comunicación al “donante de enlaces H”. Hay dos interacciones de enlace H para los donantes de enlaces H. Los elementos fuertemente electronegativos (principalmente nitrógeno, oxígeno y flúor) siempre formarán una carga negativa parcial relativamente grande cuando se unen con carbono. Estos elementos pueden aceptar enlaces H cuando forman parte de la molécula orgánica. En esta situación, solo hay una interacción H-bonding. El siguiente diagrama ilustra las similitudes y diferencias entre los donantes de enlaces H y los aceptores de enlaces H. El agua y los alcoholes pueden servir tanto como donantes como aceptores, mientras que los éteres, aldehídos, cetonas y ésteres pueden funcionar solo como aceptores. De manera similar, las aminas primarias y secundarias son donadoras y aceptoras, pero las aminas terciarias funcionan solo como aceptoras.
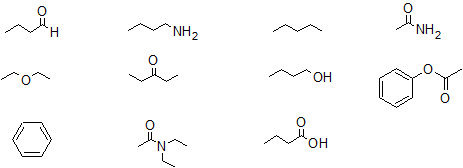
Ejercicio
1. Clasifique los siguientes compuestos como donadores de enlaces H, aceptores de enlaces H o ninguno de los dos.
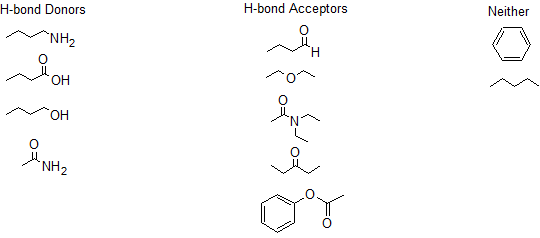
- Contestar
-
1.
Comparación de Propiedades Físicas de Donantes de Enlace H vs Aceptores de Enlace H
Una vez que somos capaces de reconocer compuestos que pueden exhibir enlaces de hidrógeno intermoleculares, los puntos de ebullición relativamente altos que exhiben se vuelven comprensibles. Los datos de la siguiente tabla sirven para ilustrar este punto.
| Compuesto | Fórmula | Mol. Wt. | Punto de ebullición | Punto de fusión |
|---|---|---|---|---|
| éter dimetílico | CH 3 OCH 3 | 46 | —24ºC | —138ºC |
| etanol | CH 3 CH 2 OH | 46 | 78ºC | —130ºC |
| propanol | CH 3 (CH 2) 2 OH | 60 | 98ºC | —127ºC |
| éter dietílico | (CH 3 CH 2) 2 O | 74 | 34ºC | —116ºC |
| propil amina | CH 3 (CH 2) 2 NH 2 | 59 | 48ºC | —83ºC |
| metilaminoetano | CH 3 CH 2 NHCH 3 | 59 | 37ºC | |
| trimetilamina | (CH 3) 3 N | 59 | 3ºC | —117ºC |
| etilenglicol | HOCH 2 CH 2 OH | 62 | 197ºC | —13ºC |
| ácido acético | CH 3 CO 2 H | 60 | 118ºC | 17ºC |
| etilendiamina | H 2 NCH 2 CH 2 NH 2 | 60 | 118ºC | 8.5ºC |
Los alcoholes hierven cosiderablemente más altos que los éteres de tamaño comparable (las dos primeras entradas), y las aminas isoméricas de 1º, 2º y 3º-respectivamente, muestran ebullición decreciente puntos, siendo los dos isómeros de enlace de hidrógeno sustancialmente mayor punto de ebullición que la 3º-amina (entradas 5 a 7). Además, los enlaces de hidrógeno O—H — O son claramente más fuertes que los enlaces de hidrógeno N—H — N, como vemos al comparar propanol con las aminas.
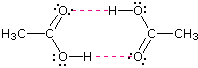
Como era de esperar, la presencia de dos funciones de enlace de hidrógeno en un compuesto eleva aún más el punto de ebullición. El ácido acético (noveno ingreso) es un caso interesante. Una especie dimérica, mostrada a la derecha, unida por dos enlaces de hidrógeno es un componente principal del estado líquido. Si esta es una representación precisa de la composición de este compuesto entonces esperaríamos que su punto de ebullición fuera equivalente al de un compuesto C 4 H 8 O 4 (peso de la fórmula = 120). Una aproximación adecuada de dicho compuesto se encuentra en el tetrametoximetano, (CH 3 O) 4 C, que en realidad es un poco más grande (peso de la fórmula = 136) y tiene un punto de ebullición de 114ºC. Así, la estructura dimérica unida a hidrógeno parece ser una buena representación del ácido acético en estado condensado.
Un principio relacionado vale la pena señalar en este punto. Aunque el enlace de hidrógeno es relativamente débil (ca. 4 a 5 kcal por mol), cuando existen varios de estos enlaces la estructura resultante puede ser bastante robusta. Los enlaces de hidrógeno entre las fibras de celulosa confieren una gran resistencia a la madera y materiales relacionados. Para obtener información adicional sobre este tema Haga clic aquí.

