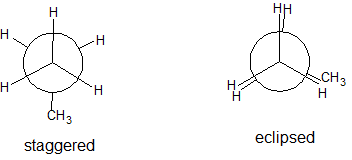4.3: Estructura y Conformaciones de Alcanos
- Page ID
- 76355
Objetivo de aprendizaje
- interpretar y dibujar la rotación alrededor de un enlace sencillo carbono-carbono usando proyecciones Newman y estructuras de caballete
- correlacionar energías de conformaciones con diagramas de energía rotacional
Rotación de enlace único e isomería conformacional
El isomerismo conformacional implica la rotación alrededor de los enlaces sigma, y no implica ninguna diferencia en la conectividad o geometría de la unión. Dos o más estructuras que se clasifican como isómeros conformacionales, o confórmeros, son realmente solo dos de la misma molécula exacta que difieren solo en términos del ángulo alrededor de uno o más enlaces sigma. Los enlaces simples carbono-carbono de los alcanos rotan libremente. Los conformadores son la misma molécula que se muestra con diferentes rotaciones de enlaces sigma. Las proyecciones Newman son una forma de comunicar la rotación de los enlaces.
Conformaciones de etano
Aunque hay siete enlaces sigma en la molécula de etano, la rotación alrededor de los seis enlaces carbono-hidrógeno no da como resultado ningún cambio en la forma de la molécula porque los átomos de hidrógeno son esencialmente esféricos. La rotación sobre el enlace carbono-carbono, sin embargo, da como resultado muchas conformaciones moleculares posibles diferentes.
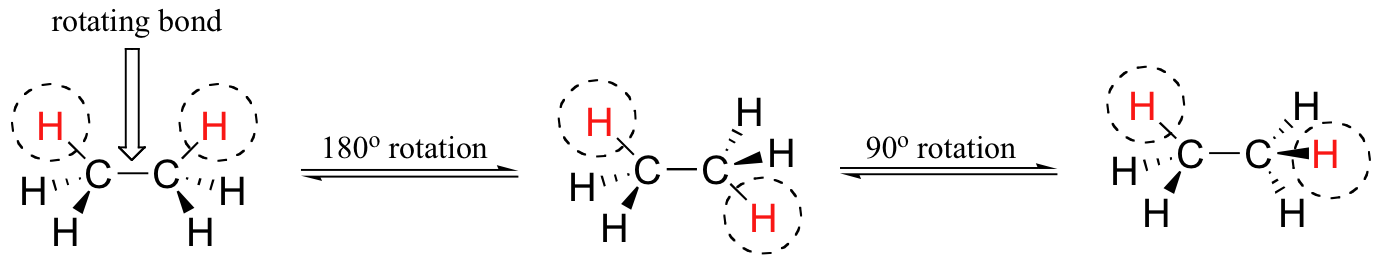
Para visualizar mejor estas diferentes conformaciones, es conveniente utilizar una convención de dibujo llamada la proyección Newman. En una proyección de Newman, miramos longitudinalmente hacia abajo un enlace específico de interés, en este caso, el enlace carbono-carbono en etano. Cuando hay múltiples carbonos, entonces especificamos el enlace de interés usando los números de carbono del nombre de la IUPAC. Nosotros representamos el átomo 'frontal' como un punto, y el átomo 'posterior' como un círculo más grande.

Los seis enlaces carbono-hidrógeno se muestran como líneas continuas que sobresalen de los dos carbonos en ángulos de 120°, que es como se ve la geometría tetraédrica real cuando se ve desde esta perspectiva y se aplana en dos dimensiones.
La conformación de menor energía del etano, mostrada en la figura anterior, se denomina conformación 'escalonada' o 'anti', en la que todos los enlaces C-H en el carbono frontal se colocan en ángulos diedros de 60°con respecto a los enlaces C-H en el carbono posterior. En esta conformación, se maximiza la distancia entre los enlaces (y los electrones en ellos).
Si ahora giramos el grupo CH 3 frontal 60°en el sentido de las agujas del reloj, la molécula se encuentra en la conformación 'eclipsada' de mayor energía, donde los hidrógenos en el carbono frontal están lo más cerca posible de los hidrógenos en el carbono posterior.
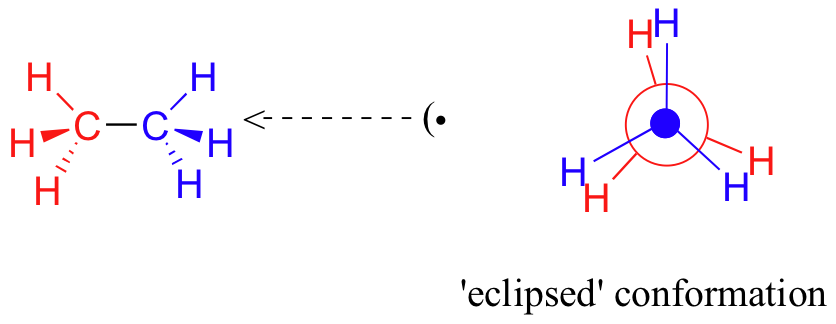
Esta es la conformación de energía más alta debido a las interacciones desfavorables entre los electrones en los enlaces C-H frontal y posterior. La energía de la conformación eclipsada es aproximadamente 3 kcal/mol mayor que la de la conformación escalonada.
Otra rotación de 60° devuelve la molécula a una segunda conformación eclipsada. Este proceso se puede continuar alrededor del círculo de 360°, con tres posibles conformaciones eclipsadas y tres conformaciones escalonadas, además de un número infinito de variaciones entre ellas.
El enlace carbono-carbono no es completamente libre de rotar; de hecho, hay una pequeña barrera a la rotación de 3 kcal/mol que debe superarse para que el enlace gire de una conformación escalonada a otra. Esta barrera rotacional no es lo suficientemente alta como para evitar una rotación constante excepto a temperaturas extremadamente frías. Sin embargo, en un momento dado es más probable que la molécula esté en una conformación escalonada -uno de los 'valles de energía' rotacionales- que en cualquier otro estado.
Las rotaciones libres no existen en etano
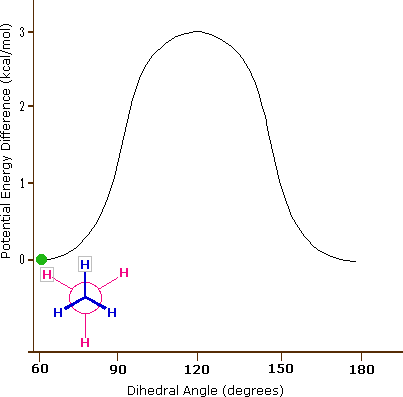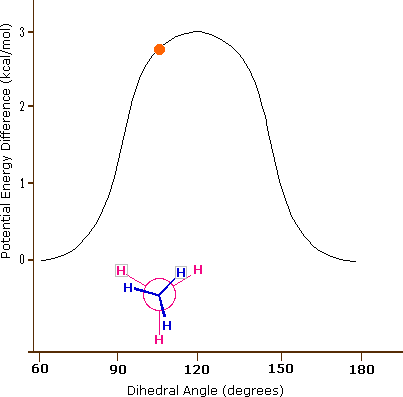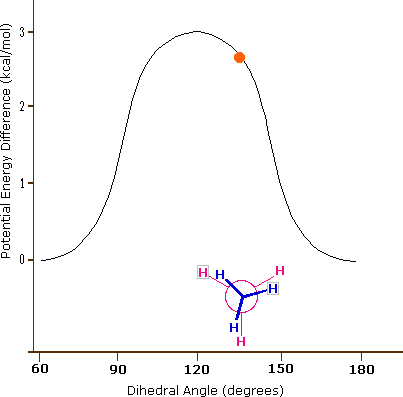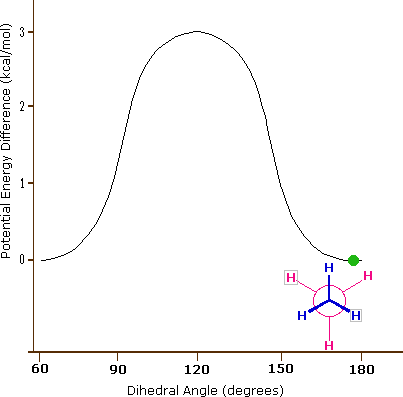
El enlace carbono-carbono no es completamente libre de rotar; de hecho, hay una pequeña barrera a la rotación de 3 kcal/mol que debe superarse para que el enlace gire de una conformación escalonada a otra. Esta barrera rotacional no es lo suficientemente alta como para evitar una rotación constante excepto a temperaturas extremadamente frías. Sin embargo, en un momento dado es más probable que la molécula esté en una conformación escalonada -uno de los 'valles de energía' rotacionales- que en cualquier otro estado. La energía potencial asociada a las diversas conformaciones del etano varía con el ángulo diedro de los enlaces, como se muestra a continuación.
La energía potencial asociada a las diversas conformaciones del etano varía con el ángulo diedro de los enlaces.
Aunque los confórmeros de etano están en rápido equilibrio entre sí, la diferencia de energía de 3 kcal/mol conduce a una preponderancia sustancial de confórmeros escalonados (> 99.9%) en cualquier momento dado. La siguiente animación ilustra la relación entre la energía potencial del etano y su ángulo diedro
Ejercicio
1. Dibuje las proyecciones de Newman para los conformadores escalonados y eclipsados de propano a lo largo del eje C1-C2.
- Contestar
-
1.